 Delokalizáció
különösen olyan esetekben történik, amikor a molekula
váltakozó (konjugált)
kettős vagy hármas kötéseket
tartalmaz, a pi-pálya
elektronjai a delokalizált
elektronok.
Delokalizáció
különösen olyan esetekben történik, amikor a molekula
váltakozó (konjugált)
kettős vagy hármas kötéseket
tartalmaz, a pi-pálya
elektronjai a delokalizált
elektronok. delokalizáció
(delokalizált elektron, delokalizációs energia)
A vegyértékelektronok kiterjedése két vagy több kötésre egy vegyületben.
Bizonyos vegyületekben az elektronok nem tekinthetők az atomok közötti adott kötésre korlátozottnak, hanem több atom felett mozognak a molekulában. Ezeket delokalizált elektronoknak nevezik.
 Delokalizáció
különösen olyan esetekben történik, amikor a molekula
váltakozó (konjugált)
kettős vagy hármas kötéseket
tartalmaz, a pi-pálya
elektronjai a delokalizált
elektronok.
Delokalizáció
különösen olyan esetekben történik, amikor a molekula
váltakozó (konjugált)
kettős vagy hármas kötéseket
tartalmaz, a pi-pálya
elektronjai a delokalizált
elektronok.
A molekula ilyen esetben stabilabb, mintha az elektronok lokalizáltak lennének.
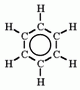
Ez az a hatás, ami a benzol
(a szerkezeti képletben) és a többi aromás
vegyület tulajdonságaiért felelős.
Az energiakülönbség a tényleges delokalizált állapot, és a lokalizált állapot között a delokalizációs energia.
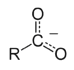 Másik
példa a karbonsavak ionjaiban, a karboxilcsoport
-COO-.
Másik
példa a karbonsavak ionjaiban, a karboxilcsoport
-COO-.
A kémiai kötések
egyszerű modellje szerint, ebben a csoportban a szénatom
kapcsolódna az oxigénnel egy kettős
kötéssel (C=O), és egy egyszeres
kötéssel a másik oxigénhez (C-O-).
Valójában a két C-O kötés azonos, mert az O- extra elektronja
és a C=O pi kötés elektronjai
delokalizálódnak a három atom felett.
Az elektronok delokalizációja jellemző a fémes kötésre is.
A molekulák delokalizációs energiája közelítően számítható a Hückel-közelítéssel, ahogy eredetileg Hückel számolta, a modern számítástechnika pedig lehetővé teszi a delokalizációs energia számítását az initio számításokkal, még nagy molekulák esetében is.