 Linus
Pauling 1931-ben alkalmazta először a metán
(CH4) molekulaszerkezetének magyarázatára.
Linus
Pauling 1931-ben alkalmazta először a metán
(CH4) molekulaszerkezetének magyarázatára. hibridizáció
(hibridpályák, elektronpálya hibridizáció, sp3 hibridizáció, sp2 hibridizáció, sp hibridizáció)
A kémiai kötés
leírására szolgáló vegyértékkötés-elmélet módszere.
Az atompályákat
olyan új hibridpályákká keveri, amelyekkel leírhatók az atomok
közötti kötés jellemzői.
Az így kialakított hibridpályák jól használhatók a molekulapályák
alakjának megmagyarázására.
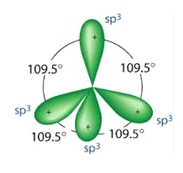
sp3 hibridizáció
 Linus
Pauling 1931-ben alkalmazta először a metán
(CH4) molekulaszerkezetének magyarázatára.
Linus
Pauling 1931-ben alkalmazta először a metán
(CH4) molekulaszerkezetének magyarázatára.
4 tetraéderes koordinációjú sp3 hibrid pálya a metánmolekulában
Az alapállapotú szénatom elektronkonfigurációja:
1s2 2s2 2px1 2py1
A hibridizáció első lépése egy vagy több elektron gerjesztése. A metán esetén ez a következő elektronkonfigurációt adja:
1s2 2s1 2px1 2py1 2pz1
A hidrogén atommagját alkotó proton vonzó hatása érvényesül a szén egyik vegyértékelektronjára.
Ez a gerjesztő hatás az egyik 2s elektront a 2p pályára viszi.
Ezeknek az erőknek a
kombinációjával alakulnak ki a hibridpályák.
A kvantummechanika
alapján, a legkisebb energiájú kötés
akkor jön létre, ha a négy kötés
egyenértékű, amihez az szükséges, hogy egyforma pályákat
alkossanak a szénatomon. A négy egyenértékű
pálya a vegyértékhéj lineáris kombinációjával érhető el (az atomtörzs
elektronjai szinte soha nem vesznek részt a kötésben)
ezért négy sp3 hibridpálya keletkezik:
1s2 sp31 sp31 sp31 sp31
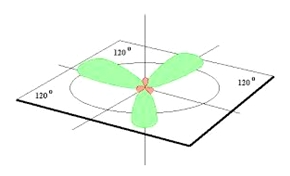
sp2 hibridizáció
 Az etilén
(H2C=CH2) molekulája
hasonló módon értelmezhető. Ebben az esetben sp2 hibridizáció történik,
amiben a 2s pálya a három 2p pálya közül csak kettővel keveredik:
Az etilén
(H2C=CH2) molekulája
hasonló módon értelmezhető. Ebben az esetben sp2 hibridizáció történik,
amiben a 2s pálya a három 2p pálya közül csak kettővel keveredik:
1s2 sp21 sp21 sp21 p1
3 síkbeli sp2 hibrid pálya
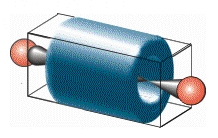
sp hibridizáció
 A hármaskötést
tartalmazó alkinek
az sp hibridizációval írhatók le, amiben a 2s
pálya a három 2p
pálya közül egy pályával keveredik:
A hármaskötést
tartalmazó alkinek
az sp hibridizációval írhatók le, amiben a 2s
pálya a három 2p
pálya közül egy pályával keveredik:
1s2 sp1 sp1 p1 p1
A p-elektronok hengeres eloszlása az acetilénben.