 Név:
Név:Mercury-(a Merkur bolygóról);
a hydrargyrum folyékony ezüstöt jelent.
higany / Hg
(merkuro-vegyületek, merkuri-vegyületek)
 Név:
Név:
Mercury-(a Merkur
bolygóról);
a hydrargyrum folyékony ezüstöt jelent.
Felfedezés:
Az ókori Kínában és Indiában már ismerték, már i.e. 1500-ból származó egyiptomi
sírokban megtalálták.
Rendszám: a periódusos rendszer 80. eleme
Relatív atomtömeg: 200,61
Elektronkonfiguráció: [Xe](4f)14(5d)10 (6s)2
Izotópok: Hét stabil 196-204 közötti tömegszámmal
Előfordulás:
Elemi állapotban csak nagyon ritkán fordul elő.
Egyetlen fontos ásványa
a cinóber, vagy cinnabarit
(HgS).
A szfaleritben és a tetraedritben is található néha járulékos
alkotórészként.
Előállítás:
Szulfidjából, levegőn
való pörköléssel állítják elő:
HgS + O2 = Hg + SO2
Az ércet hevíthetik kalcium-oxiddal
is:
4 HgS + 4 CaO = 4 Hg + CaSO4 + CaS.
A higany gőz állapotban
távozik és könnyen lecsapatható. A hűtők rozsdamentes acélból
készülnek; 500-600°C körül végzik a redukciót
és a desztillációt.
A nyers higanyt tisztításakor a mechanikai szennyezéseket szarvabőrön
átszűrve távolítják
el.
Ezután híg salétromsavval
vagy anódosan tisztítják.
Higany-nitrátból elektrolitikusan
az anódon leválik a
tiszta higany.
Tisztítják desztillációval
is vákuumban, így
azonban a cink és a kadmium
nem távolítható el.
Fizikai tulajdonságok:
Ezüstös színű, a fémek
között egyedülálló, mivel szobahőmérsékleten
folyékony halmazállapotú.
A hőt és az áramot sokkal kevésbé vezeti, mint a fémek
általában.
Sűrűsége 13,595 g
/cm3
Olvadáspontja -39°C
Forráspontja 357°C
Kémiai tulajdonságok:
A cinkcsoport utolsó eleme.
Hidrogénnel nem egyesül;
halogének már közönséges hőmérsékleten
megtámadják.
Oxigén tiszta higanyra szobahőmérsékleten
nem hat, csak forráspontja közelében, szennyezett higany közönséges hőmérsékleten
is oxidálódik.
Kénnel közönséges hőmérsékleten
is egyesül (ezért
szokták a törött lázmérő után kénporral
felszórni).
Szelénnel és tellurral
hevítve egyesül.
Nitrogén nem hat rá.
Cseppfolyós foszforban oldódik, arzénnel
és antimonnal is vegyül.
Víz nem hat rá, híg savak
csak erős oxidáló szerek
jelenlétében oldják.
Lúgok és ammónia
nem hatnak rá.
Ötvözetei, az úgynevezett
amalgámok szilárdak
vagy folyékonyak
lehetnek.
Kétféle ionja a (Hg2)2+
az úgynevezett merkuro-vegyületeket és és a Hg2+ merkuri-vegyületeket
alkotja.
Sói közt vannak ion
vegyületek, pl. a nitrátok,
továbbá kovalens kötésű
atomvegyületek,
pl. HgS, és molekulavegyületek
is, pl. Hg2Cl2.
A (Hg2)2+ ionvegyületei
könnyen oxidálódnak
merkurivegyületekké; fémes
higany jelenlétében a kétféle vegyület
közt egyensúly alakul ki.
Mindkét fajta higanyion
szintelen.
A higany könnyen alkot kovalens
kötést is, pl. szénnel és nitrogénnel.
Minden higany vegyület
szétesik hevítéskor.
Amalgámjai közül
némelyik vegyületnek
mondható, mert határozott összetételű és kristályrácsú.
Vannak olyan fémek, amelyek
nem alkotnak amalgámot
pl. a vas, a mangán
és a platinafémek.

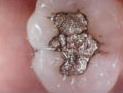
 Felhasználás:
Felhasználás:
Műszerek, hőmérők (baloldai kép), laboratóriumi készülékek, elektromos
kapcsolók, stb. készítéséhez sok higanyt használnak.
A Gyógyszerként és fogászati célra is sok higany fogyott (a középső
képen amalgám tömés látható).
Vegyületei
gombák, baktériumok és rovarok elleni szerekként
alkalmazzák. Fertőtlenítésre is használnak
higany vegyületeket.
A higany(II)-fulminátot [Hg(CNO)2] gyutacs készítésére
használják.
A cinóbert színezőanyagként (pigmentként)
használják.
Higanygőz lámpákban, fénycsövekben
(jobboldali kép) alkalmazzák.
A kősó elektrolízisénél
katódként használják
nátrium és klór
előállításához.
Biológia:
Gőze és oldható sói
igen mérgezőek és a szervezetben felhalmozódnak; különösen virulens formája
a környezetben a CH3Hg+ ion.
Az EU most készül betiltani szinte valamennyi alkalmazását, pl. lázmérőkben
sem használnak többet higanyt.