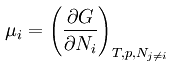
G a rendszer Gibbs-energiája, J
ni az i komponens anyagmennyisége, mol
p a nyomás, Pa
T a hőmérséklet, K
kémiai potenciál
(parciális moláris szabadentalpia, parciális moláris Gibbs-energia)
A kémiai folyamatok
irányát és egyensúlyát meghatározó tényező; elegyekben
az egyes komponensek
parciális moláris szabad entalpiájának
(hőtartalmának) a
kémiai termodinamikában
szokásos neve.
A kémiai potenciált parciális moláris szabadentalpiának,
parciális moláris Gibbs-energiának
is nevezik, ami egy parciális moláris mennyiség.
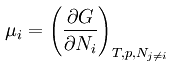 |
ahol: G a rendszer Gibbs-energiája, J ni az i komponens anyagmennyisége, mol p a nyomás, Pa T a hőmérséklet, K |
Ha valamely komponens
kémiai potenciálja egy anyagi rendszer különböző helyein különböző, akkor
ez a komponens a
nagyobb kémiai potenciálú helyekről a kisebb kémiai potenciálúakra
megy át.
Ha viszont valamely komponens
kémiai potenciálja a rendszer minden helyén egyenlő, akkor ez a komponens
a rendszerben egyensúlyban van.