kén / S
(Sulfur, rombos kén, monoklin kén, romboéderes kén, barna kén, terméskén, Claus-eljárás, kénvirág)
 Név: Sulfur- (Sanskrit -sulvere; Latin - sulpur)
Név: Sulfur- (Sanskrit -sulvere; Latin - sulpur)
Rendszám: a
periódusos rendszer 16. eleme
Felfedezés:
Már az ókorban is ismerték, Egyiptomban, rómában használták is.
Az alkimisták tudták,
hogy a cinóber ként és higanyt
tartalmaz.
Fontosságát a puskapor, majd a kénsavgyártás
elterjedése fokozta.
Relatív atomtömeg:
32,064
Elektronkonfiguráció: [Ne](3s)2(3p)4
Izotópok:
11 izotópja létezik
A természetben 4 stabil izotópja
fordul elő.
Fizikai tulajdonságok:
Számos módosulata
van;
Szobahőmérsékleten
és közönséges nyomáson
a rombos kén stabilis, ez előfordul ásványként
is, néha szép, nagy kristályokban. A szilárd
kén 113 °C-on megolvad,
és 440 °C-on forr.
Az olvasztott kén lehűtésekor monoklin
kristályok keletkeznek, amelyek lehülve rombos kénné alakulnak, az
átmeneti hőmérséklet
atmoszferikus nyomáson
95,5 °C.
Ismerünk romboéderes és barna ként is. A rombos
és a monoklin kén
8 atomos gyűrű alakú
molekulákból áll.
Az amorf kén
szabálytalan láncok tömege.
Az olvadt kén világossárga, híg folyadék
8 atomos gyűrű alakú
molekulákból áll.
Tovább hevítve megbarnul, a gyűrűk
felhasadnak és különböző hosszúságú molekulaláncok képződnek.
Vízben oldhatatlan.
Szén-diszulfidban jól, benzolban és alkoholban
kissé oldódik.
Kémiai tulajdonságok:
Kevésbé aktív az oxigénnél.
Levegőn, közönséges
hőmérsékleten nagyon
lassan oxidálódik;
meggyújtva halványkék lánggal
ég el kén-dioxiddá.
Gyulladási hőmérséklete
250°C.
Hidrogénnel 400°C körül visszafordíthatóan
kén-hidrogénné egyesül.
Fluorral, heves reakció közben kén-hexafluoridot
alkot.
Klórral a folyékony kén dikén-dikloridot
ad (S2Cl2),
brómmal hasonlóan reagál,
de a jód nem hat rá.
Szénnel magas hőmérsékleten
szén-diszulfiddá egyesül.
Nitrogénnel nem reagál, foszforral,
arzénnel, antimonnal
és bizmuttal összeolvasztva szulfidokat
képez.
Az Ia és IIa
oszlop fémeivel közvetlenül
szulfidokká egyesül,
hevítve más fémekkel
(pl. vassal, cinkkel)
is reagál.
Nemesfémekekkel,
az ezüst kivételével nem reagál.
Oxidáló savak és tömény
alkálilúgok oldják.
Ionvegyületeiben
szulfidion, S2-
vagy hidrogén-szulfidion (HS-) vagy több kénatomból álló ionok
formájában van jelen.
A szulfidok között
vannak ion vegyületek
(pl. alkálifémekkel) és vannak kovalensek
(pl. ZnS)
Negatív elemekkel molekulavegyületeket
alkot.
Vegyértéke 2, 4 vagy
6 lehet, pl. H2S, SO2 és SO3
Szerves vegyületek
kéntartalmának meghatározására a Carius-módszert alkalmazzák.
Előfordulás:
A természetben sok helyen található terméskén (elemi kén).
Ásványai között fontosak
a szulfidok, pl.
a pirit (FeS2),
galenit (PbS),
szfalerit
és wurtzit, mindkettő (ZnS), kalkopirit
(CuFeS2), a cinóber
(HgS).
Nagy telepeket alkotnak egyes szulfátok
is pl. thénardit (Na2SO4),
keserűsó vagy epsomit (MgSO4.7 H2O), gipsz
(CaSO4.2 H2O), anhidrit
(CaSO4).
Előállítás:
A természetes ként szublimálással,
esetleg szén-diszulfidos oldatából
átkristályosítva lehet tisztítani.
Kén keletkezik pirit hevítésekor is:
FeS2 = FeS + S
A földgázban, vagy
a szén desztillációjával kapott gázokban
gyakran jelentős mennyiségű kén van, főleg kén-hidrogén,
és szerves kénvegyületek
formájában. Ez az égetésnél kén-dioxiddá,
esetleg kén-trioxiddá
alakul, mindkettő mérgező
és erősen környezet szennyező (savas
esők), korrodáló.
Ezért Claus-eljárással kinyerik a ként, kéntelenítik a
tüzelőanyagot
Vas(III)-oxid-hidroxid
tartalmú tisztítómasszával kötik meg a kén-hidrogént:
3 H2S + 2 FeOOH = Fe2S3 + 4 H2O
Nedves levegőn a
használt massza regenerálódik:
Fe2S3 + 3 O2 + 2 H2O = 4FeOOH +
6 S
Többször felhasználható, amikor kéntartalma 50% fölé emelkedik a kénsavgyártásnál
használják fel, elégetéssel kén-dioxidot
nyernek belőle.
Kolloid kén
előállitható szulfidok
és szulfitok egymásrahatásával
savanyú oldatban.
A kéngőzök lecsapódásakor keletkező finom eloszlású kénport kénvirágnak
nevezik.
 Felhasználás:
Felhasználás:
Nagyon sok célra használnak ként.
A kénsavgyártás hatalmas
mennyiségeket használ fel, a termelés kb. felét.
Az elemi ként használják növényvédő
szerként és a borászatban (a képen borászati kénlapok), továbbá gumi
vulkanizálására,
fekete lőpor készítésére,
gyufa gyártásnál, tűzijáték
töltetekhez.
Kévirágot használnak gyógyászati kenőcsök készítésére és növényvédőszerként.
Vegyületei pl. szén-diszulfid,
dikén-diklorid, stb. a festékgyártásban,
gyógyszergyártásban,
stb. használatosak.
A papíriparban is használják
a cellulóz gyártásához.
Egyes vegyületei
rendkívül büdösek, a dietil-szulfidot
használják pl. a földgáz
szagosítására.
Mesterségesen előállított
radioaktív izotópját (radioaktív kén)
radioaktív nyomjelzésre
használják, pl. a gyógyászatban.
Biológia:
Minden élő szervezet számára nélkülözhetetlen, mint egyik fontos aminosav
(cisztin) alkotója.
A zsírok, váz anyagok
fontos összetevője.
Oxidjai mérgezőek.
Felhasznált irodalom
 Név: Sulfur- (Sanskrit -sulvere; Latin - sulpur)
Név: Sulfur- (Sanskrit -sulvere; Latin - sulpur)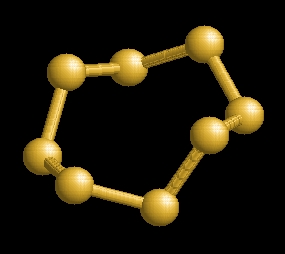
 Felhasználás:
Felhasználás: