 H2SO4
H2SO4
kénsav
(tetraoxokén(VI)sav, kamra eljárás, kontakt eljárás, E 513)
 H2SO4
H2SO4
A teljes szisztematikus neve tetraoxokén(VI)sav. Régóta ismert, erős kétbázisú
sav.
A kénsav molekulaképe balra golyó és pálcika jobbra térkitöltéses megjelenítésben.

|
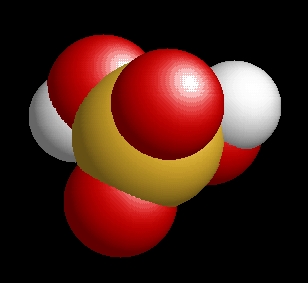
|
A h2so4.pdb koordináta fájl térben megjeleníthető a https://sourceforge.net/projects/openrasmol/ címről letölthető molekulamegjelenítő programmal
Történet
Már a középkori alkimisták
ismerték.
A XVIII. században vezette be a Roebuck az ólomkamrás eljárást Angliában.
A kontakt kénsavgyártást 1831-ben találta fel Philips, de csak 1900-ra
fejlődött ki iparilag.
Előfordulás
Megtalálható bizonyos hőforrásokban és néhány csiga nyálmirigyének váladékában
is.
Előállítás
A kontakt kénsavgyártás alapja, hogy a kén-trioxidot vízben
nyeletik el:
H2O + SO3 = H2SO4
Kén-dioxid megfelelő oxidálása után kénsav állítható elő. Oxidálószerként salétromsavat, illetve a belőle keletkező nitrogén-oxidokat ("nitrózus gázokat") alkalmazza a kamraeljárás a következő módon:
H2O + SO2 + NO2 = H2SO4 + NO
a nitrogén-oxidot levegő befuvatással nitrogén-dioxiddá oxidálják:
2NO + O2 = 2NO2
A nitrogén-dioxid tehát regenerálódik és így elméletileg nem is kellene további salétromsavat hozzáadni, a valóságban azonban szükséges kisebb mennyiségű salétromsav pótlás, mert mellékreakciók fogyasztják a nitrogén-oxidokat. A közbenső termékek közé tartozik a nitrozil-kénsav (HOSO2ONO) is, amely az úgynevezett kamrakristályok alakjában rakódik a kamra falára, ha a vízgőz nem elegendő. Ez azonban vízzel szétesik kénsavra és NO + NO2 elegyére.
Iparilag kétféle eljárást alkalmaznak:
A kamra eljárással 60-80%-os kénsavat termelnek főleg szuperfoszfát
gyártásához.
A kontakt eljárással (ábra) 98%-os kénsavat, valamint fölöslegben
lévő kén-trioxidot tartalmazó úgynevezett oleumot (füstölgő kénsavat)
gyártanak. Ezt hígítják a megfelelő töménységre.

Fizikai tulajdonságok
 A tiszta kénsav színtelen, olajszerű folyadék, lehűtve megfagy,
A tiszta kénsav színtelen, olajszerű folyadék, lehűtve megfagy,
Olvadáspontja +10°C
Forráspontja 338 °C
ezen a hőmérsékleten
azonban már kén-trioxidra és vízgőzre bomlik.
Agresszív vízelvonószer. (A kristálycukor
például elszenesedik a tömény kénsavban, mivel, még vegyületeiből
is képes a vizet elvonni! - baloldali
kép)
Híg vizes oldata bepárlással 98,3%-os töménységig koncentrálható,
az ilyen sav sűrűsége 1,84 g/cm3.
A kénsav nehezebben párolog, mint sok más sav.
A kénsavoldat vezeti az elektromos áramot, vezetőképessége a töménységtől
függ, a 30%-os oldat vezetőképessége a legnagyobb.
Kémiai tulajdonságok
Erős kétbázisú sav.
Tömény állapotban igen erősen roncsol oxidálható, főleg szerves anyagokat.
Forrón a ként, foszfort,
szenet, stb. is oxidálja.
A híg kénsav az aktívabb fémeket hidrogénfejlődéssel oldja. A tömény
kénsav előbb oxidálja, majd oldja a kevésbé aktívakat is, ha forró pl.
a rezet és az ezüstöt is.
A tömény kénsav a kovácsolható acélt nem támadja meg, a sziliciumacélt
még kevésbé.
Az ólmot csak a nagyon tömény kénsav oldja.
Sói a szulfátok előállíthatók a megfelelő fém, fém-oxid, -hidroxid vagy -karbonát
kénsavban történő feloldásával, vagy más sók kénsavas hevítésével.
Nehezen oldható
szulfátok a megfelelő
fém oldható
sójának oldatából kénsavval leválaszthatók, pl. ólom-nitrát oldatból
ólom-szulfát:
Pb(NO3)2 + H2S04 = PbS04
+ 2 HNO3
 Felhasználás, termelés
Felhasználás, termelés
A legnagyobb mennyiségben gyártott ipari vegyszer.
Rendkívül széles körben használják.
Legnagyobb mennyiségben nyersfoszfát
feltárására, szuperfoszfát
műtrágya gyártásához.
Ammónium-szulfát műtrágya
előállításához.
Más savak (pl. hidrogén-fluorid,
foszforsav) illetve
szulfátok (pl. réz-szulfát)
előállításához.
Robbanóanyagok (pl.
dinamit, TNT)
gyártásához.
Ásványi és növényi olajok
tisztítására.
Fémek pácolására.
Akkumulátorokban elektrolitként
(a képen híg kénsav gépkocsi akkumulátorokhoz) .
Szerves anyagok
előállítására, szulfonálásra, nitráláshoz.
Sok kénsavat használnak a műanyagiparban
és a textiliparban.
Alkalmazzák festékalapanyagok
és detergensek gyártásához.
Deszikkáns szerként.
Az élelmiszeriparban sav-szabályzóként
használják.
Élelmiszeradalékként
kódja E 513.
Kimutatás, meghatározás
Oldata bárium-kloriddal fehér, por alakú csapadékot,
bárium-szulfátot ad
ez vízben és híg savakban
oldhatatlan. Súlyából a kénsav mennyisége kiszámítható.
Jellemző a benzidinnel (C6H5NH-NHC6H5)
keletkező, ugyancsak oldhatatlan, kristályos
csapadék, amely
alkalmas a kénsav mennyiségének meghatározására.