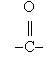 (ketocsoport) két alkilgyökkel
egyesül, az oxovegyületek egyik csoportját jelentik.
(ketocsoport) két alkilgyökkel
egyesül, az oxovegyületek egyik csoportját jelentik. ketonok
A ketonokban a karbonilgyök
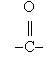 (ketocsoport) két alkilgyökkel
egyesül, az oxovegyületek egyik csoportját jelentik.
(ketocsoport) két alkilgyökkel
egyesül, az oxovegyületek egyik csoportját jelentik.

|
|
A szisztematikus (genfi) nomenklatúrában a ketonokat az alap szénhidrogénnel
képzett -on végződéssel jelölik. Például propanon (aceton) (H3C-CO-CH3), és ( butanon (metil-etil-keton): CH3COC2H5. Megjelölik azt a szénatomot,
amin az oxigén található. Pl. a H3C.CO.CH2CH2CH3 vegyület neve 2-pentanon.
Lehetséges elnevezés a karbonil csoporttal kapcsolódó szénhidrogéngyökök
megnevezése, ami pl. az aceton esetén
dimetil-keton.
Ha a két alkilgyök
egyforma, akkor egyszerű ketonról (pl. dimetil-keton)
, ha különböző, akkor vegyes ketonról (pl. metil-etil-keton) beszélhetünk.
A legyegyszerűbb keton az aceton
(H3C-CO-CH3), ennek nevéből származik a "keton" szó.
Vannak továbbá aromás és aromás-alifás csoportot is tartalmazó ketonok.
 |
Néhány (alifás-alifás; aromás; aromás-alifás) keton molekulaképe (A nyilakkal válthatja a molekulaképeket.) |
Előállítás
a) Másodrendű (szekunder) alkoholok oxidációjával (ilyenkor a -C-OH-csoport -C=O-csoporttá alakul):
H3C-COH-CH2 + O -> H3C-CO-CH2 + H2O
További oxidációval szemben a ketonok ellenállóbbak, mint az aldehidek, de nagyon erős oxidálószerek a ketonokat elhasíthatják, kisebb szénatomszámú karbonsavakká.
b) Karbonsavak kalcium-sóinak
száraz desztillációjával
is ketonokat kapunk:

Vegyes karbonsavas kalcium-sókból
vegyes ketonok keletkeznek. Ezt az eljárást a fadesztillációnál alkalmazták,
amely ma már nem használatos.
c) Sav-kloridokból Grignard-reagenssel átmeneti vegyületeken keresztül ketonok keletkeznek:
CnH2n+1COCl + H3C-MgCl -> CnH2n+1CCl.OMgCl.CH3 -> CnH2n+1COCH3 + MgCl2
d) Karbonsavészterek kondenzálhatók, ha reakcióképes metilén- vagy metilcsoportot tartalmaznak, tehát olyat, amely CO-csoporthoz van kötve. Így az etil-acetát, nátrium-alkoholát hatására acet-ecetésztert ad:
H3C-COOC2H5 + HCH2COOC2H5 -> H3C-CO-CH2-COOC2H5 + C2H5OH
Így tehát egy molekula etanol kilép. A kapott vegyület egy b-ketosav-észter, amely gyenge lúg hatására elbomlik:
H3C-CO-CH2-COOC2H5 -> H3C-CO-CH3 + CO2
Végeredményben keton képződik. Más észterekből is ki lehet indulni.
Fizikai és kémiai tulajdonságok
A sorozat első tagja könnyen mozgó, szintelen folyadékok,
Vízben jól oldódnak.
A molekukalasúly
növekedésével az oldhatóság
csökken, a forráspont
és az olvadáspont
emelkedik.
Kémiailag nagyon hasonlítanak az aldehidekhez,
bizonyos jellemző különbségekkel.
Oxidációs viselkedésüket
már láttuk, egyéb jellemző reakcióik:
a) Erős redukcióval
ketonokból másodrendű alkoholok
keletkeznek.
Ez az ismert előállítási reakció megfordítása. Lehet a reakciót
úgy is végezni, különleges körülmények között, hogy nem másodrendű alkohol,
hanem kétértékű, ditercier alkohol (pinakon) keletkezik:
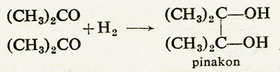
A redukció elektrolitosan
is végezhető, higany katódon
lúgos oldatban.
A pinakon kénsav hatására átrendeződik
pinakolinná, amely harmadrendű szénatomot
tartalmazó keton:
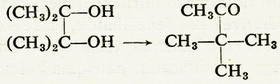
b) Nátrium-hidrogén-szulfittal a ketonok is reagálnak, és ugyanúgy,
mint az aldehidek addíciós vegyületeket alkotnak:
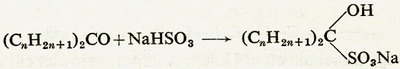
Az addíciós vegyületekből
a keton híg savval vagy lúggal főzve regenerálható.
c) Hidrogén-cianiddal ciánhidrin keletkezik:

Az aldehidektől eltérően azonban a ketonok nem reagálnak a Fehling-oldattal vagy a Tollens-reagenssel, és nem oxidálhatók könnyen.