 Iparilag
a kősó (NaCl) oldatából
elektrolízissel.
Iparilag
a kősó (NaCl) oldatából
elektrolízissel.
2 NaCl + 2 H2O = Cl2 + H2 + 2 NaOH
klór / Cl
(Deacon-eljárás, E 925)
Név: chloros = zöldessárga (görögül)
Rendszám:
a periódusos rendszer 17. eleme. A halogéncsoport 2. eleme.
Felfedezés:
Vegyületeit ugyan
már régóta ismerték, magát a klórt csak 1774-ben állította elő C.
Scheele svéd vegyész. Davy
kimutatta, hogy elem
és színéről nevezte el.
Fizikai tulajdonságok:
Sárgászöld színű, nehéz fojtó szagú, mérgező gáz.
Néhány atmoszféra nyomáson,
közönséges hőmérsékleten
cseppfolyósítható;
erősen lehűtve sárga kristályokká
fagy, amelyek kétatomos
molekulákból álló
rácsot alkotnak.
Vízben jól oldódik,
Olvadáspontja 109,98°C
Forráspontja -35,453°C,
Sűrűsége 3,214 g/dm3.
Relatív atomtömeg:
35,453
Izotópjai:
Két stabil izotópja
van 35 illetve 37-es tömegszámmal,
előfordulásuk súlyaránya 3:1.
Elektronkonfiguráció:
[Ne](3s)2(3p)5
Kémiai tulajdonságok:
Cl2 molekulákból
áll, igen magas hőmérsékleten
atomjaira disszociál.
Nagyon aktív elem,
rögtön a fluor után következik aktivitása.
Sok elemmel és vegyülettel közvetlenül reagál.
Hidrogénnel, halogénekkel,
kénnel, foszforral,
arzénnal, bizmuttal
közvetlenül egyesül;
oxigénnel és nitrogénnel
csak közvetve.
Aktívabb fémekre (alkáli-,
alkáliföldfémekre) hevesen hat, szárazon
a vasat nem támadja meg, vas
tartályban szállítható.
Vízzel sósavat
és hipoklórossavat ad:
Cl2 + H2O = HCl + HOCl
Alkáli-hidroxid
oldattal alkáli-hipokloritot
és -kloridot ad:
Cl2 + 2 NaOH = NaCl + NaOCl + H2O
A szénhidrogéneket
klórozza, egyik hidrogén atom
a másik után cserélődik ki:
CH3 + Cl2 = CH3Cl + HCl
CH3Cl + Cl2 = CH2Cl2 + HCl
stb. A szénhidrogének
klórozása iparilag is fontos.
Vegyületei 1, 3, 5, 7 oxidációs állapotban tartalmazzák.
Ionvegyületekben
egy vegyértékű Cl-
anion fordul elő, pl.
a konyhasóban.
Vannak összetett klór tartalmú anionok
is, pl. ClO3-, ClO4-, stb.
Atomvegyület pl.
a réz(I)-klorid (CuCl).
Nemfémes elemekkel
molekulavegyületet
alkot, pl. CCl4, ClF3, S2Cl2, stb.
Előfordulás:
A természetbenszéles körben előfordul. Leggyakrabban kloridok, elsősorban kősó (NaCl) alakban fordul elő. Megtalálható a karnallitban (KCl.MgCl2.6H2O) és a szilvinben (KCl)
A tengervíz 3% NaCl-ot
tartalmaz.
Előállítás:
 Iparilag
a kősó (NaCl) oldatából
elektrolízissel.
Iparilag
a kősó (NaCl) oldatából
elektrolízissel.
2 NaCl + 2 H2O = Cl2 + H2 + 2 NaOH
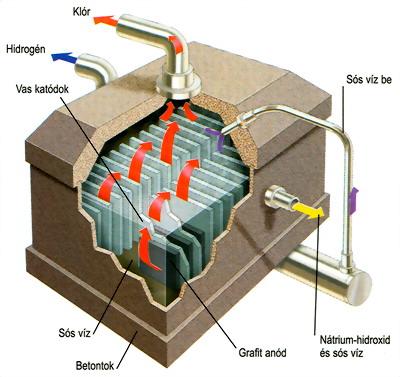
Az ábrán a kősó elektrolizáló cella felépítése látható.
Előállítható sósavból
mangán-dioxiddal, kromátokkal, stb.
MnO2 + 4 HCl = MnCl4 + 2 H2O
MnCl4 = Cl2 + MnCl2
Ennek egy Henry Deacon (1822-76) által 1870-ben szabadalmaztatott változata
a Deacon-eljárás amelynek során a sósav
oxidálása réz(II)-klorid katalizátor alkalmazásával történik 450°C-on.
A Downs-eljárásnál a nátrium előállításakor is keletkezik.
Felhasználás:
 Az iparban a klórt elsősorban szerves szintézisekben
használják fel hajtógázok, tisztítófolyadékok és monomerek előállításához.
Az iparban a klórt elsősorban szerves szintézisekben
használják fel hajtógázok, tisztítófolyadékok és monomerek előállításához.
Széleskörűen alkalmazzák mint erős fertőtlenítőszert, pl. ivóvíz előállításnál,
uszodákban.
Az élelmiszeriparban E 925 kóddal említik.
Fehérítőszerként alkalmazzák a papír- és textiliparban.
A szerves vegyiparban oxidálószerként
és helyettesítésre használják, klórozott-szénhidrogének gyátásánál. (pl. vinil-klorid
- PVC).
Biológia:
Munkahelyeken a megengedett legnagyobb koncentrációja 0,5 ppm.
Rendkívül erős méreg, légzőszervi, nyálkahártya és bőr irritációt okoz.
Az első világháborúban harcigázként használták.