 Név: magnes, magnet, (latin) (a piroluzit mágneses tulajdonságai
alapján)
Név: magnes, magnet, (latin) (a piroluzit mágneses tulajdonságai
alapján) mangán / Mn
(tükörvas, ferromangán, mangán(II)-vegyületek, manganovegyületek,
mangán(III)-vegyületek, manganivegyületek)
 Név: magnes, magnet, (latin) (a piroluzit mágneses tulajdonságai
alapján)
Név: magnes, magnet, (latin) (a piroluzit mágneses tulajdonságai
alapján)
Felfedezés:
Már az ókorban ismert volt.
C. Scheele és Bergman
különítették el, mint elemet.
Gahn 1774-ben állította elő dioxidját szénnel
redukálva.
Rendszám: a periódusos rendszer 25. eleme
Relatív atomtömeg: 54, 9381
Elektronkonfiguráció: [Ar](3d)5(4s)2
Izotópok: egy stabil az Mn(55) tömegszámú
Előfordulás:
Ásványai közül
legfontosabb a barnakő (MnO2),
más néven piroluzit. Két másik
oxid ásványa a manganozit (MnO)
és a Bixbyit (Mn2O3).
Gyakori a rodokrozit (MnCO3)
és a rodonit (MnSiO3) is.
Minden vasérc tartalmaz 1-2% mangánt.
Nagy mennyiségben található oxidja a tengerek fenekén mangánrögök formájában
Előállítás:
Oxidjai szénnel magas hőmérsékleten
fémmé redukálhatók,
de az így kapott mangán széntartalmú.
Kohászati célra sokszor csak vasötvözetét állítják elő, amelyet tükörvasnak
vagy ferromangánnak neveznek.
Tiszta mangán elektrolízissel
állítható elő ammónium-szulfát és mangán(II)-szulfát
oldatának elegyéből.
Az így kapott fém, csak
hidrogént tartalmaz, ami vákuumban,
hevítéssel eltávolítható.
Fizikai tulajdonságok:
Három módosulata
van, mindegyik ezüstfehér, törékeny.
Az ektromos áramot
közepesen vezeti.
Sűrűsége 8,89 g/cm3,
olvadáspontja 1260°C.
Kémiai tulajdonságok:
A mangáncsoport első eleme.
Aktivitása kb. a cinkével egyezik.
Levegőn és oxigénben
a tömör fém, csak felületén
oxidálódik, de finom
eloszlásban oxigénben eléghet.
Halogénekkel egyesül.
Nitrogénnel, foszforral,
szénnel és sziliciummal
magas hőmérsékleten
egyesül.
Sósavgázzal magas hőmérsékleten
mangán(II)-kloridot ad.
Víz lassan már hidegen megtámadja.
Híg ásványi savakban
oldódik, alkáliákban
nem.
A két vegyértékű
mangánvegyületek
(mangán(II)-vegyületek /manganovegyületek/) , amelyekben a mangán
+2 oxidáció fokkal
található, elég állandó ionvegyületek.
A három vegyértékű
mangánvegyületek
(mangán(III)-vegyületek /manganivegyületek/) , amelyekben a mangán
+3oxidáció fokkal
található, sói sokkal
kevésbé állandóak.
A négy vegyértékű
mangán pedig amfoter.
Hat vegyértékű mangán
a manganát-ionban (MnO42-).
Hét vegyértékű mangán
a permanganát-ionban (MnO4-)
fordul elő. A hét vegyértékű mangán molekulavegyülete
a mangán-heptoxid (Mn2O7).
Felhasználás:
 Majdnem minden acél
tartalmaz mangánt, amely egyrészt dezoxidálásra, másrészt káros kéntartalom
kivonására és végül ötvözésre
használatos. Növeli az acél
szilárdságát, szívósságát.
A mangánacélt tengelyek, keményacél, páncél lemezek előállítására használják.
Majdnem minden acél
tartalmaz mangánt, amely egyrészt dezoxidálásra, másrészt káros kéntartalom
kivonására és végül ötvözésre
használatos. Növeli az acél
szilárdságát, szívósságát.
A mangánacélt tengelyek, keményacél, páncél lemezek előállítására használják.
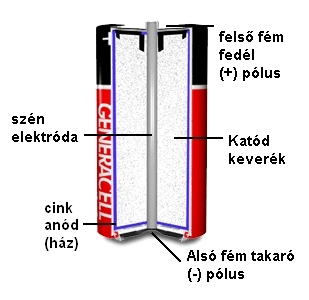
Vegyületei közül a mangán-dioxidot száraz elemek gyártásánál (a képen
látható cink-szén elem katód keverékében mangán-dioxid található), az üvegiparban
szintelenítésre, száradó olajok kezelésére, kerámia
gyártásnál használják
A kálium-permanganát vizes oldata könnyen kezelhető, erős oxidálószer.
Bizonyos ötvözetei
(aluminummal és antimonnal,
különösen egy kevés rézzel) erősen ferromágnesesek.
Biológia:
A mangángőzök
és a por toxikusak, mennyisége nem haladhatja meg az 5 mg/m3 értéket
a levegőben.
Ugyanakkor fontos nyomelem.
A felnőtt szervezetben mintegy 10-20 mg-nyi mennyiségben található meg. Kis
mennyisége ellenére számos enzim felépítésében és működésben vesz részt. Hatással
van a szénhidrát- és a zsíranyagcserében,
a fehérje-, DNS-
és RNS-szintézisben. Részt vesz az úgynevezett mukopoliszacharidok képzésében
(például gyomorban). Különösen lényeges a B1
vitamin felhasználásához.
A legtöbbet a gabonafélék, a dió és a mogyoró tartalmazza. A gabonafélékben
annál több van, minél többet tartalmaz a héjából, tehát minél barnább.