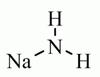
 NaNH2
NaNH2nátrium-amid
 NaNH2
NaNH2
Gay-Lussac és Thénard fedezték fel 1811-ben.
Előállítás
Száraz ammóniát fém nátrium felett átvezetve 350°C-on:
2 Na + 2 NH3 -> 2 NaNH2 + H2
Fizikai és kémiai tulajdonságok
Tiszta állapotban fehér, ammóniaszagú kristályos
por. (Általában szürkés színű a gyártás során belekerülő vasszennyezés miatt.)
Hexagonális kristályokat
alkot.
Olvadáspontja 210°C
Forráspontja 400°C
Sűrűsége 1,846 g/cm3
Vízben és meleg etanolban
bomlik.
NaNH2 + H2O -> NH3 + NaOH
Vörösen izzó szénnel reagálva nátrium-cianidot ad.
Dinitrogén-oxiddal reagálva nátrium-azid keletkezik.
Híg sósavban igen hevesen feloldódik nátrium-klorid és ammónium-klorid keletkezésével:
NaNH2 + 2 HCl = NaCl + NH4Cl
Erősen izzítva nátrium-nitriddé (Na3N) alakul.