 Név: natron = szóda
Név: natron = szódanátrium / Na
 Név: natron = szóda
Név: natron = szóda
Rendszám: a periódusos rendszer 11. eleme
Felfedezés:
A kősó (NaCl) ősidők
óta ismert.
Az egyiptomiak a szódát
(Na2CO3) is ismerték és használták.
A fémet Humphry
Davy 1807 - nátrium-hidroxid-olvadék
elektrolízisével
állította elő.
Relatív atomtömeg: 22,98977
Izotópjai:
stabil - 23Na,
radioaktív izotóp:
14 féle
Elektronkonfiguráció:
[Ne](3s)1
Fizikai tulajdonságok:
Ezüstfehér, puha, könnyűfém.
Folyékony higanyban, ólomban
és káliumban oldódik
Köbös rácsszerkezetű,
Sűrűsége a vízénél
kisebb (0,970 g/cm3)
Olvadáspontja 97,8
°C.
Elektromos és hővezető
képessége a rézének kb. 40%-a.
Kémiai tulajdonságok:
Alkálifém.
Nedves levegőn nagyon gyorsan nátrium-hidroxiddá oxidálódik, ezért petróleum
alatt tárolják.
Levegőn könnyen meggyullad, csak poroltóval oltható
 Vízzel
hidrogénfejlődés közben reagál (ez
látható a képen)
Vízzel
hidrogénfejlődés közben reagál (ez
látható a képen)
2Na + H2O = 2NaOH + H2
Halogénekben illetve azok gőzében sárga
lánggal közvetlenül sót képez
2Na + Cl2 = 2NaCl
Hidrogénnel 200 °C fölött hidriddé
egyesül.
Az oxigéncsoport elemeivel,
valamint foszforral és bizmuttal
hevítve egysül, továbbá szénnel, sziliciummal
és germániummal is.
Lángfestése intenzív sárga színű, ez a vegyületeire is jellemző, konyhasóval (NaCl) bárki kipróbálhatja.
Vegyületeiben
vegyértéke 1. általában
ionvegyületeket alkot,
de vannak atom-,
molekula- és fémes
vegyületei is.
Az egyszerű nátriumsók
vízben általában jól oldódnak. Rosszul oldódik a nátrium-fluorid, oldhatatlan
a nátrium-hexahidroxi-antimonát.
Előfordulás:
Elemi állapotban nem fordul elő.
Vegyületeiben nagyon
elterjedt (kősó - NaCl; szóda - Na2CO3; kriolit
- Na2[AlF6]; stb).
A konyhasó a tengervízből
is kivonható, amelynek kb. 2,7%-át alkotja.
Előállítás: Szóda magas hőmérsékleten szénnel
fémmé redukálható:
Na2CO3 + 2 C = 2 Na + 3 CO
Célszerűbb a NaOH olvadékelektrolízise.
Ekkor az áramkihasználás csak 50%-os, mert az anódon
víz keletkezik és ez reagál a már levált nátrium fémmel:
Na3 + e- -> Na (a katódon)
2 OH- = H2O + 1/2 O2 + e- (az anódon)
Előnyösebb a nátrium-klorid elektrolízise, de csak
zsugorított korundból készített készülék
alkalmas, mert a klór magas hőmérsékleten majdnem
minden más anyagot megtámad.
Előállítják Downs-eljárással is nátrium-kloridból.
Felhasználás:
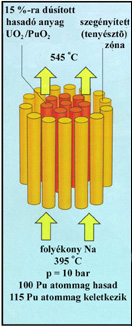 Atomreaktorok cseppfolyós
hűtőközege (a
képen egy gyors tenyésztőreaktorban).
Atomreaktorok cseppfolyós
hűtőközege (a
képen egy gyors tenyésztőreaktorban).
Redukálószerként
- könnyűfémek előállításánál.
Használják továbbá alumínium gyártásnál,
mosó- és fehérítőszerekhez, nátrium-lámpákhoz,
nátrium-cianidot (NaCN) állítanak elő belőle, amelyet a fémkohászatban használnak.
A nátrium-karbonát (Na2C03) és a nátrium-bikarbonát (NaHCO3), ismertebb nevükön mosószóda és szódabikarbóna, fontos ipari
vegyületek, akárcsak a nátrium-hidroxid (NaOH) vagy marólúg,
amelyet szappankészítésre is használnak.
Biológia:
A növények nátrium szükségletét nem kell műtrágyával
fedezni, mert a talaj
mindenütt többet tartalmaz, sőt a túlzott nátrium tartalmú, szikes talaj
káros.
Az élő szervezetek számára nélkülözhetetlen.
Az emberi szervezetben körülbelül 80-100 gramm nátrium található meg,
nagyobb része oldott állapotban van, kisebb részét pedig a csontok, kötőszövetek
raktározzák.
A káliummal szorosan összefüggve fontos szerepe van az úgynevezett ozmózis
nyomás biztosításában. Ugyanilyen elengedhetetlen az ingerületi
folyamatokban és az izomműködésben is.
További szerepe van a sav-bázis
egyensúly fenntartásában, és a sejtek energiaellátásában
is.
Részt vesz a fehérje-
és a szénhidrát-anyagcserében és a
folyadékháztartás szabályozásában.
Minden élelmiszerünkben megtalálható kisebb-nagyobb mennyiségben. Az állati
eredetű termékek inkább nátriumot, a növényiek inkább káliumot
tartalmaznak. A modern táplálkozástudományi ajánlások szerint érdemes a jobb
nátrium-kálium arányú növényeket
előnyben részesíteni.
Fontos a szervezet nátrium-kálium-kalcium
egyensúlyának fenntartása.
Hiánya a jelenlegi táplálkozás mellett nem, feleslege annál inkább előfordul, ami növeli a vérnyomást.