(NO2)
(N2O4)

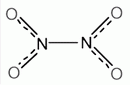


nitrogén-dioxid
(nitrogén-tetroxid, dinitrogén-tetroxid)
A nitrogén-oxidok közé tartozó vörösbarna gáz (NO2), illetve színtelen folyadék (N2O4).
|
nitrogén-dioxid
(NO2) |
nitrogén-tetroxid
(N2O4) |
 |
 |
 |
 |
Előfordulás
Nitrogén-dioxid keletkezik a nitrogén-oxid
levegőn történő oxidációja
során:
2 NO + O2 = 2 NO2
Előállítás
Száraz ólom(II)-nitrát hevítésével:
Pb(NO3)2 = 2 NO2 + PbO2
Tiszta nitrogén-dioxid (NO2) gáz azonban nem állítható elő, mert a hőmérséklettől függően egyensúlyban van a nitrogén-tetroxiddal (N2O4):
2 NO2 <-> N2O4
Laboratóriumban könnyen előállítható réz és tömény salétromsav reakciójával.
Dinitrogén-oxidot tartalmazó kevert nitrogén-oxidok előállíthatók fémnitrátok hevítésével is.
Fizikai és kémiai tulajdonságok
A nitrogén-dioxid (NO2) vörösbarna gáz.
A nitrogén-tetroxid (N2O4) színtelen vagy halványsárga folyadék.
Sűrűsége 1,45 g/cm3
Olvadáspontja -11,2°C
Forráspontja 21,2°C
Az N2O4 diamágneses.
Vízzel reagál, salétromsav és salétromossav keveréke keletkezik.
A dimer nitrogén-tetroxid (N2O4) alacsony hőmérsékleten
tisztán is előállítható.
Magasabb hőmérsékleten a gáz
színe mindig sötétebb, mert a tiszta monomer (NO2) szaporodik fel,
ami igen sötét színű.
A nitrogén-dioxid (NO2) páratlan elektront
tartalmaz, ezért paramágneses.
Erősen oxidáló hatású.
Magasabb hőmérsékleten (600°C felett) teljesen szétesik oxigénre
és nitrogén-oxidra:
2 NO2 = 2 NO + O2
Könnyen oxidálódó
anyagok elégnek benne.
Aktívabb fémeket megtámad.
Vízzel salétromsavat és nitrogén-oxidot ad:
3 NO2 + H2O = 2 HNO3 + NO
A keletkezett nitrogén-oxid
levegőn újból nitrogén-dioxiddá oxidálódik, míg az egész nitrogén-dioxid
(NO2) salétromsavvá
nem alakul.
Alkálilúgokkal nitrát és nitrit keletkezik belőle:
2NO2 + 2 KOH = KNO3 + KNO2 + H2O
A szilárd vegyület teljesen, a folyadék a forrásponton 99%-ban N2O4-ból áll.