nitrogén / N
(nitrogénkörforgás, E931)
Név: nitrogenium = salétromképző
Rendszám: a periódusos rendszer 7. eleme
Felfedezés: C. Scheele és Daniel Rutherford 1772
Relatív atomtömeg: 14,0067
Izotópjai:
stabil - 14N (99,64%); 15N (0,36%),
6 radioaktív izotóp
létezik, felezési idejük
ms-tól ~10 percig tart.
Elektronkonfiguráció: [He](2s)2(2p)3
Fizikai tulajdonságok:
Színtelen, szagtalan, íztelen gáz.
Forráspontja -196
°C.
Az égbolt napkeltekor látható ibolya és narancsszínű árnyalata a nitrogénre
vezethető vissza.
Sűrűsége a levegőénél
kisebb (0,81 g/cm3).
Vízben az oxigénnél rosszabbul oldódik,
így a természetes vizekben több az oxigén,
mint a nitrogén
Kémiai tulajdonságok:
Kétatomos molekulát
alkot (N2).
Nem éghető anyag.
Oxidációs száma +1-től +5-ig és -1-től -3-ig változhat.
Atomos állapotban nagyon reakcióképes, molekuláris állapotban renyhe, rendkívül
stabil (háromszoros kovalens
kötés).
Szobahőmérsékleten néhány alkáli- és alkáliföldfémekkel nitrideket képez
N2 + 3Mg = Mg3N2
Hidrogénnel ammóniát alkot
N2 + 3H2 = 2NH3
Oxigénnel nitrogén-monoxiddá alakul
N2 + O2 = 2NO
Előfordulás:
A világegyetemben a hidrogén, a hélium és a szén után a leggyakoribb elem. A
Földön kevésbé gyakori.
Elemi állapotban a levegő 78%-a, a leggyakoribb gáz
az atmoszférában.
A nitrogénásványok
közül a chilei salétrom (NaNO3) fordul elő nagyobb mennyiségben.
Előállítás: Levegőből cseppfolyósítással
Felhasználás:
 Hegesztésnél védőgáz.
Hegesztésnél védőgáz.
Ammóniagyártás a
Haber-Bosch-eljárás
segítségével.
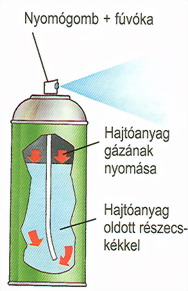
Aeroszolos palackok
(a képen) hajtógáza.
Tűzoltó készülékek töltőgáza.
Nitrogénvegyületek, nitrogénműtrágyák
alapanyaga.
Robbanószerekben
a nitrogénmolekula (N2) háromszoros kovalens
kötésének visszaalakulásakor felszabaduló jelentős energiát
használják fel.
Az élelmiszeriparban E931 kóddal említik, mint csomagológázt alkalmazzák.
Biológia:
Minden élőlény szervezete tartalmaz nitrogént, fontos alkotórésze a fehérjéknek
és az aminosavaknak.
A levegőből nitrifikáló
baktériumok kötik meg, (pillangósok gyökérgumóiban élnek) a nitrogénvegyületeket
a növények a talajból
felveszik.
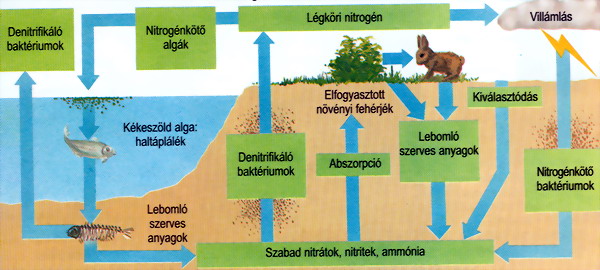
A nitrogénkörforgás egyes folyamatai (nitrifikálás, denitrifikálás) külön
címszóban megtalálhatók.
Az alábbi ábrán a nitrogénkörforgás látható a természetben.
Felhasznált irodalom
 Hegesztésnél védőgáz.
Hegesztésnél védőgáz.
