 Név:
stannum - latin
Név:
stannum - latinón / Sn
(stannum, ónpestis, fehérbádog, sztaniolpapír, fehérfém, csapágyfém, Babbit-fém, forrasztóón)
 Név:
stannum - latin
Név:
stannum - latin
Rendszám: a periódusos rendszer 50. eleme
Felfedezés:
Bár a legrégebben ismert fémek
közé tartozik (elsősorban ötvözete
a bronz használatos
évezredek óta), régeben nem mindíg különböztették meg biztosan az ólomtól.
Relatív atomtömeg: 118,7
Izotópok:
Összesen 21 izotópja
van 112-124 közötti tömegszámmal (ez az elemek közt a legnagyobb szám). Ezek közül 5 radioaktív izotóp.
Elektronkonfiguráció: [Kr](4d)10(5s)2 (5p)2
Előfordulás:
Fő ásványa a kassziterit
vagy ónkő (SnO2).
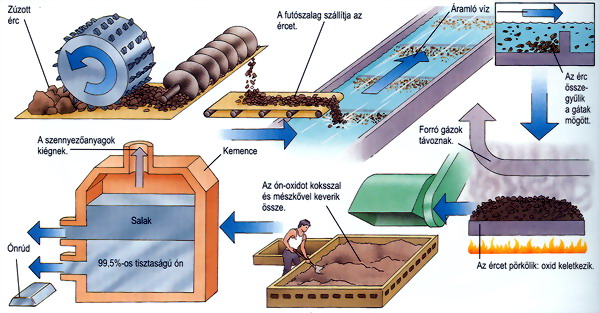
Előállítás:
Az ón-dioxidot szénnel redukálják
fémmé:
SnO2 + 2 C = Sn + 2 CO
A salak ón-metaszilikátot is tartalmaz, ezért újra feldolgozzák. Hulladékokból
is nyernek vissza ónt, ónozott vasbádog hulladékot szárazon klórral
kezelve, ón-tertakloriddá alakul, ez könnyen desztillálható.
Az ón előállítási folyamata
Fizikai tulajdonságok:
Több módosulata
van;
közönséges hőmérsékleten
és e fölött 161°C-ig tetragonális
stabil fehér ón,
18°C alatt szürke ónná alakul, +161°C fölött rombos.
A szürke ón nemfémes,
rideg, porítható, az elektromos
áramot nem vezeti. Rácsa gyémánt típusú.
Alacsonyabb hőmérsékleten
a fehér ón foltokban szürke ónná alakul, az ilyen óntárgyak könnyen
porladnak, tönkremennek. Ezt nevezik "ónpestisnek". Ez az átalakulás, mely 100°C fölé melegítve visszafordítható.
Sűrűsége 7,28 g/cm3
Olvadáspontja 231,88°C
Forráspontja 2260°C
Kémiai tulajdonságok:
Az óncsoport első eleme.
Közepesen pozitív fém,
két vagy négy vegyértékű.
Két sorozat vegyülete létezik, a +2 és +4 oxidációs állapotban.
Levegőn lassan oxidálódik.
Hidridje illó, nagyon
bonlékony.
Halogénekkel közvetlenül egyesül,
tetrahalogenidek keletkezése közben.
Oxigénben elégethető; kénnel,
szelénnel és tellurral
is egyesül.
Nitrogénnel nem egyesül,
foszforral hevítve igen.
Arzénnel, antimonnal,
bizmuttal ötvözeteket
alkot.
Híg savak lassan oldják,
forró, tömény kénsav
gyorsabban.
Tömény salétromsav
melegítve oldhatatlan ón-dioxiddá oxidálja,
hideg savval ón(II)-nitrát
keletkezik.
Forró alkálilúgokban
hidroxo-sztannátok keletkezésével oldódik:
Sn + 2 OH- + 4 H2O = Sn(OH)62- + 2 H2
Komplex halogenosztannát gyököket is ismerünk, pl. SnCl42- és SnCl62-.
Felhasználás:
 Vas
tárgyak ónozására (korrózióvédelem).
Az ónnal bevont vaslemez a fehérbádog, aminből konzervdobozokat
készítenek, szerves
savakkal szemben ellenálló.
Vas
tárgyak ónozására (korrózióvédelem).
Az ónnal bevont vaslemez a fehérbádog, aminből konzervdobozokat
készítenek, szerves
savakkal szemben ellenálló.
Tiszta fémből edényeket,
kisebb szobrokat öntenek.
Nagyon vékonyra hengerelhető. Régebben fóliát
készítettek belőle ("sztaniolpapír"), ma már az olcsóbb alumíniumot
használják helyette.
Nagy mennyiségű ónt használnak ötvözetekhez,
a bronz az ón
és a réz ősidők óta használt ötvözete,
szobrok, harangok, gépalkatrészek öntésére használatos.
Az úgynevezett fehérfém (csapágyfém) ötvözet
összetétele réz (5-10%) ón (10-80%)
antimon (5-15%). Nevezik Babbit-fémnek
is, mivel az ötvözetet 1839-ben az amerikai Isaac Babbit (1799-1862) találta
fel.
A lágyforrasztáshoz
75% ón és 25% ólom ötvözetét
(forrasztóón) használják.
Biológia:
Nem mérgező, sói nagy
mennyiségben legfeljebb gyomorrontást okozhatnak.