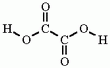
 C2H2O4,
(COOH)2, HOOC-COOH
C2H2O4,
(COOH)2, HOOC-COOHA legegyszerűbb dikarbonsav.
oxálsav
(etándisav, etándikarbonsav, sóskasav, oxalátok)
 C2H2O4,
(COOH)2, HOOC-COOH
C2H2O4,
(COOH)2, HOOC-COOH
A legegyszerűbb dikarbonsav.
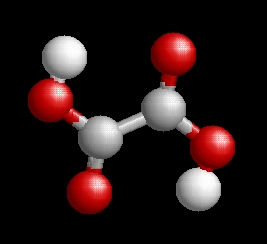
Az oxálsav molekulaképe balra golyó és pálcika jobbra térkitöltéses megjelenítésben.
|

|
Az Oxalsav.pdb koordináta fájl térben megjeleníthető a https://sourceforge.net/projects/openrasmol/ címről letölthető molekulamegjelenítő programmal
Történet
Scheele állította elő 1776-ban cukor salétromsavas oxidációjával.
Előfordulás
Sóskában és madársóskában szabad oxálsav található.
Sok növényben található kalcium-oxalát, ami ásványként is előfordul.
Előállítás
a) Dicián hidrolízisével.
b) Etilén-glikol oxidációjával.
c) Iparilag cellulóz
(fűrészpor) kálium-hidroxiddal
történő megömlesztésével 250°C-on kálium-oxalát
állítható elő.
d) Készítik nátrium-formiát 440°C-ra
történő hirtelen felmelegítésével. Ekkor hidrogén
fejlődik és nátrium-oxalát
marad hátra:
2 HCOONa -> (COONa)2 + H2
e) Nátrium és szén-dioxid 360°C-on történő reakciójakor nátrium-oxalát keletkezik:
2Na + 2CO2 -> (COONa)2
Fizikai és kémiai tulajdonságok
A vízmentes oxálsav színtelen kristályokból áll.
Oldatából dihidrát kristályosodik ki.
Szublimációspont: 157°C
Olvadáspont: 189,5°C
(elbomlik)
Sűrűség: 1,9 g/cm3
Vízben mérsékelten oldódik.
Hevítve elbomlik:
(COOH)2 -> CO2 + CO + H2O
Savas oldatban permanganát szén-dioxiddá és vízzé oxidálja. Ezt a reakciót
mangán(II) ion katalizálja és titrimetriában gyakran használatos.
Az oxálsav sói
az oxalátok.
 Felhasználás
Felhasználás
A méhészetben oldatát atka elleni védekezésre.
A textílszínezésnél pácként.
Rozsdafoltok eltávolítására.
Fémtárgyak tisztítására.
Biológia
Szemre, bőrre, légzőrendszerre maró hatású.
Belélegzése tüdővizenyőt okozhat.