oxigén / O
(tripla oxigén, triplet oxigén, oxigénkörforgás)
Név: oxygenium = savképző
Rendszám: a
periódusos rendszer 8. eleme
Felfedezés:
C. Scheele és
J. Priestley 1772-ben
állítottak elő tiszta oxigént.
Lavoisier francia
kémikus mutatta ki, hogy az égés
oxigénnel való egyesülés;
ezzel megvetette a modern kémia
alapját.
Relatív atomtömeg:
15,9994
Izotópok:
stabil - 16O (a természetes oxigén zöme); 17O; 18O.
Ezen kívül 10 radioaktív
izotóp létezik, felezési
ideik ms-perc nagyságrendűek
Elektronkonfiguráció:
[He](2s)2(2p)4
Fizikai tulajdonságok:
Színtelen, szagtalan, íztelen gáz,
forráspontja -183°C,
sűrűsége 1,14 g/cm3.
A folyékony oxigén halványkék, még jobban lehűtve világoskék kristályokká
fagy.
Két allotrop módosulata
létezik: O2 és O3 (ózon).

|

|
Vízben 2 °C-on 3,03 térfogatszázalék oldódik.
Kétatomos molekulái
csak igen magas hőmérsékleten kezdenek disszociálni (2000°C-on kb. 1%).
Az oxigénmolekula stabil, alapállapotát, tripla oxigénnek, vagy triplet oxigénnek nevezik. Ebben két elektron spinje párhuzamosan, azonos irányba áll, és az antiblokkoló molekulapályékon helyezkedik el, ezért az oxigénmolekula egy biradikális, ami kisebb reakcióképességet eredményez, mint az úgynevezett szinglett oxigén. Fontos szerepet játszik a biológiában és a légkörben, mint a leggyakoribb oxigénforma.
Egyes szilárd anyagok, pl. platinafémek,
faszén, korom,
stb. nagy mennyiségű oxigént tudnak a felületükön megkötni (adszorbeálni).
Jellemző az oxigénre, hogy paramágmneses,
tehát inhomogén mágneses tér taszítja.
Kémiai tulajdonságok:
A közönséges, kétatomos molekulákból
álló oxigén nem nagyon aktív. Éghető, azaz oxidálható anyagok a hőmérséklet
emelkedésével egyre gyorsabban oxidálódnak,
míg bekövetkezik az égés,
ami tovább növeli a hőmérsékletet.
Reakcióképes, csaknem valamennyi elemmel
energia felszabadulása
mellett oxidokat képez.
A gázok lánggal égnek,
szilárd testek csak
izzanak, pl. faszén.
Az égéshez megfelelő
hőmérséklet szükséges,
a koksz pl. sok hőt
fejleszt, de ha nincs magas hőmérsékleten,
akkor az égés megszűnik.
Szilárd anyagok égése,
csak nagy fajlagos felületen lehetséges; izzított vaslemez
pl. csak a felületén oxidálódik,
finom vaspor viszont izzítva teljesen elég
(csillagszóró).
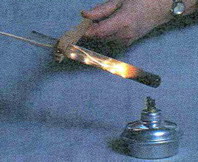 Tiszta oxigénben
a vastag vasdrót is vakító fényben ég
el olvadt magnetitté
(Fe3O4) (a képen).
Tiszta oxigénben
a vastag vasdrót is vakító fényben ég
el olvadt magnetitté
(Fe3O4) (a képen).
Az égés tiszta oxigénben
hevesebb, mint levegőn. Cseppfolyós oxigénben gyakran robbanásszerű.
C + O2 = CO2
4P + 5O2 = 2P2O5
2Ca + O2 = 2CaO
Hidrogénnel igen hevesen egyesül;
a hidrogén-oxigén elegy meggyújtva
5...95% hidrogén tartalomnál felrobban
(durranógáz), közönséges hőmérsékleten
és katalizátor távollétében
hosszú ideig változatlan marad.
2H2 + O2 = 2H2O
Halogénekkel az oxigén nem reagál.
A kén, a szelén
és a tellur levegőn könnyen elég.
Nitrogénnel csak az elektromos ív hőmérsékletén
egyesül (pl. villámláskor).
A nitrogéncsoport többi elemei (P,
As, Sb,
Bi) közvetlenül oxidálhatók.
A szén, ha nagy felületű, könnyen elég
(faszén) egyébként
csak erős izzításkor oxidálódik
jelentősebben.
Magas hőmérsékleten
elég a szilicium, a germánium
és a bór is.
A fémek nem kívánatos
oxidációja a korrózió.
Oxigénnel majdnem minden fém
oxidálható, az arany,
ezüst és platinafémek
kivételével. Az oxidációt
a tömör felületi oxidréteg
meggátolhatja.
Az ózon (az oxigén 3
atomos allotrop
molekula változata), erős oxidációs
képessége miatt mérgező.
Vegyületeiben oxidációs száma -2, ritkán -1, kovalens
kötésű és ionos kötésű
vegyületei egyaránt
léteznek
A fémek oxidjai ionvegyületek,
néha már atomvegyületekhez
való átmenetet alkotnak (pl. Cu2O, CuO). A fémoxidok közül az alkálifémek
és a földalkálifémek oxidjai bázisanhidridek,
vízzel reagálva hidroxidokat
alkotnak, amelyek vízben oldhatók (csak
a berilium és a magnézium
oxidjai oldhatatlanok. Igen magas hőmérsékleten
az oxidok szétesnek,
pl. a mangán-dioxid:
MnO2 -> Mn2O3 -> Mn3O4 -> MnO -> Mn + O
A negatív elemek
oxidjai sokszor molekulavegyületek,
néha azonban egy- vagy háromdimenziós, végtelen hálózatot alkotnak, mint pl.
a szilicium-dioxid
módosulatai.
A nemfémek oxidjai
közt vannak savanhidridek,
pl. SO3, CO2, P2O5, stb., de nem
savanhidrid pl a NO,
F2O, GeO.
Előfordulás:
Normál állapotban a levegő
21 %-a.
Kémiailag kötött formában a kőzetekben
és a vízben megtalálható.
A földkéreg felső
részének leggyakoribb eleme (50,5% - a levegő
és vízburkot is beleértve).
A szerves anyagok
nagy részében megtalálható.
Előállítás:
Levegőből - cseppfolyósítással.
Az oxigén forráspontja
13 °C-kal magasabb, mint a nitrogéné,
ezért a levegő szakaszos lepárlásával
elkülöníthető.
Millió tonnás nagyságrendben állítják elő évente.
 Felhasználás:
Felhasználás:
Autogén hegesztésnél
(a kék palackban van az oxigén),
acélgyártásnál,
termikus krakkoláshoz,
szintézisgáz,
salétromsav előállításához,
rakéta üzemanyagaként,
légzőkészülékekben,
szennyvizek biológiai tisztításánál.
Az élelmiszeriparban E-948 kóddal, mint csomagológázt
alkalmazzák.
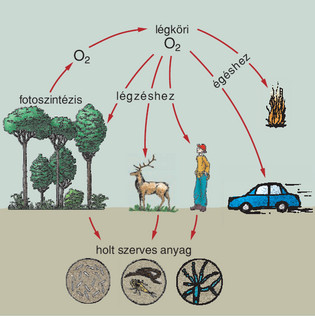 Biológia:
Biológia:
A légköri
oxigén nagy része fotoszintézis
eredetű.
Légzési gáz, a belélegzett levegőben legalább 7% oxigénnek kell lenni.
A tiszta oxigén belélegzése viszont rövid idő
alatt keringési rendellenességekhez vezet.
Egy ember óránként 20 liter
oxigént fogyaszt, évente 300 kg oxigént használ fel.
Az oxigén körforgása a természetben
Az oxigénkörforgás az oxigént tartalmazó, vegyületek
dinamikus körforgása a légkör,
a talaj és az élő
szervezetek között.
Az oxigén körforgása számos ponton érintkezik más anyagok (pl. a nitrogén
vagy a víz) körforgásával.
Főbb biológiai lépései: gáz formájú oxigén felhasználása az állatok és növények
légzése során, amikor is víz és szén-dioxid keletkezik, majd ezen termékeknek
a felvétele a zöld növények fotoszintézise során, amely viszont gázállapotú
oxigén felszabadulását eredményezi.