réz / Cu
(alpakka /újezüst/, sárgaréz, delta-sárgaréz, ólombronz, tombak /hamisarany/, konstantán, deltafém, monelfém)
 Név: Cuprum - latin (Ciprus szigetének nevéből - már az ókorban fontos
rézlelőhely volt.)
Név: Cuprum - latin (Ciprus szigetének nevéből - már az ókorban fontos
rézlelőhely volt.)
Rendszám: a
periódusos rendszer 29. eleme
Felfedezés:
Már az őskorban ismerték és szerszámokat készítettek belőle. A rézkorszak
után a bronzkorszak következett.
Izotópok:
Két stabil
Számos, rövid élettartamú, mesterséges radioaktív
izotópja létezik
Relatív atomtömeg: 65,34
Elektronkonfiguráció: [Ar](3d)10(4s)1
Előfordulás:
Termésréz (elemi állapotban) elég gyakran előfordul.
Szulfidos és oxidos ércek
nagyobb tömegben fordulnak elő, pl. kalkopirit
(CuFeS2), kalkozit (Cu2S) és kovellin (CuS).
Szulfo-arzenid, illetve szulfo-antimonid az enargit
(Cu3AsS4) és a tetraedrit
(Cu3SbS3).
Oxidok a kuprit
(Cu2O) és a tenorit (CuO); karbonátok
a malachit
[CuCO3.Cu(OH)2] és azazurit
[2 CuCO3.Cu(OH)2].
Majdnem háromszáz különböző rézásványt
ismerünk.
Nem ritka elem, a
földkéreg a levegő
és a tengerek összes
tömegének 0,007 %-át teszi ki.
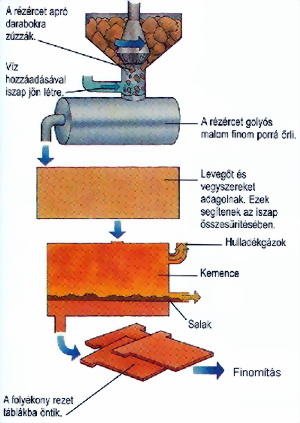
Előállítás:
 Oxidjából hidrogénnel vagy szénnel
redukálható.
Oxidjából hidrogénnel vagy szénnel
redukálható.
Tiszta réz állítható elő sóinak
oldatából elektrolízissel,
ezt azonban inkább raffinálásra használják.
A bányászott rézércek általában kevés rezet tartalmaznak; ma már 1% rezet
tartalmazó ércet is érdemes
feldolgozni.
Először dúsítják, főleg flotációval,
vagyis úsztatással, így 20-30%-ra nő a koncentrátum réztartalma. Nedves
úton szokták az érc réztartalmát
kioldani.
A koncentrátum pörkölésekor réz-oxid keletkezik, az arzén
és az antimon, pedig oxidok formájában
elpárolog.
A jelenlévő vas(II)-szulfid részben szilikáttá alakul:
2 CuO + FeS + C + SiO2 = Cu2S + FeSiO3 + CO
A megolvadt tömegből a nehéz Cu2S és FeS alul gyűlik össze és megszilárdulva
ún. kéneskövet ad, amelyben 50% réz van. Ezt lángkemencében pörkölve
részben oxidálják,
majd levegő kizárásával hevítve redukálják:
2 Cu2S + 3 O2 = 2 Cu2O + 2 SO2
2 Cu2O + Cu2S = 6 Cu + SO2
így "feketeréz" keletkezik 70-99% réztartalommal, a vas
elsalakosodik.
A feketeréz lángkemencében, oxidáló olvasztás hatására kén
és más szennyezés tartalmának nagyobb részét elveszti, de sok oxigént
vesz fel. Ezért nyers fadorongokkal keverik, a keletkező vízgőz
és szén-dioxid az oxidot nagyobbrészt
redukálja; a kapott
réz 99,5%-os.
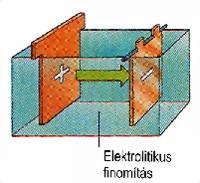 Ezt azonban
még tovább kell finomítani.
Ezt azonban
még tovább kell finomítani.
Ez elektrolízissel
(raffinálás) történik. Ekkor 99,95%-os nagytisztaságú
rezet kapnak.
A réz tisztasága nagyon fontos a jó elektromos vezetőképességhez.
Fizikai tulajdonságok:
Rézvörös, közepesen kemény, szívós fém.
Nagyon jó elektromos vezetőképességét 0,5% arzén
vagy foszfor negyedére csökkenti.
Sűrűsége 8,97 g/cm3
Olvadáspontja 1083°C
Kémiai tulajdonságok:
A rézcsoport első eleme.
Kevéssé aktív fém, hidrogénnel
csak közvetve egyesíthető, halogénekkel
egyesül.
Fluor hatására felületén CuF2 védőréteg
keletkezik, ezért fluorral rézkészülékekben
lehet dolgozni.
Klór, bróm
és jód - különösen nedvesség jelenlétében
- gyorsan megtámadja.
Oxigén még magas hőmérsékleten
is lassan hat rá, fekete CuO réteg keletkezik rajta.
Kénnel sajátságos módon könnyebben egyesül,
mint oxigénnel.
Vízgőz még magas hőmérsékleten
sem reagál vele.
Ammóniával magas
hőmérsékleten nitridet
ad.
Szén-monoxid nyomás
alatt sem hat rá.
Híg kénsav, csak oxigén
jelenlétében oldja lassan, tömény kénsav
melegítve oxidálja,
majd oldja:
Cu + H2SO4 = CuO + SO2 + H2O
CuO + H2SO4 = CuSO4 + H2O
Salétromsav különböző
módon hat rá a töménységtől függően. Híg salétromsav
nem oldja, nitrition jelenlétében igen. Tömény salétromsav
oxidálja, majd oldja:
3 Cu + 8 HNO3 = 3 Cu(NO3)2 + 2NO + 4 H2O
Igen tömény alkálilúgok
is megtámadják, ha oxigén van jelen.
Ammónium-hidroxid,
oxigén jelenlétében gyorsan oldja, mert
komplex ionok keletkezése
közben minden védőréteget felold.
Kálium-cianid oldat is oldja, ha levegő van jelen.
Szénsav és oxigén,
vagy kén-dioxid és
oxigén a réz felületét lassan
zöld patinává alakítja;
a patina bázisos rézsókból
áll.
Vas(III)-sók oldata is oldja a rezet, mert oxidáló
hatásuak (ezzel is szoktak nyomtatott áramköri rajzolatokat maratni).
Egy vagy két vegyértékű
alakban fordul elő, ritkán három vegyértékű
is lehet.
A Cu3+ ion
szintelen, a Cu2+ ion
víz jelenlétében kék vagy zöld.
Atomvegyületek az
oxidok, szulfidok,
stb. némely rézsó, pl. az acetát
sajátos molekulavegyület,
amelyben két rézatom között kovalens
kötés van.
Gyakoriak a komplex ionok.
Felhasználás:

 A vas és az alumínium
után a legnagyobb tömegben termelt fém.
A vas és az alumínium
után a legnagyobb tömegben termelt fém.
Az elektrotechnikában
nélkülözhetetlen.
Csöveket (baloldali kép), elektromos vezetékeket (jobboldali kép)
tartályokat, edényeket készítenek belőle.
Hajók, kupolák, tetők borítására használják.
Fontosak ötvözetei:
- A sárgaréz, amely 20-45% cinket
tartalmaz.
Csapok, kilincsek,
csavarok, stb. készítésére használják.
- A delta-sárgaréz erős, kemény típusú sárgaréz, ami a réz
és cink mellett kis százalékban vasat
is tartalmaz.
Főleg töltényhüvelyek készítésére használják.
- A bronz 14%-ig
terjedő mennyiségű ónt tartalmaz, jól önthető,
kovácsolható, sajtolható.
Minimális foszforral dezoxidált
bronz készíthető.
- Az alpakka (újezüst) 5-30% nikkelt
és 13-35% cinket tartalmaz.
Evőeszközöket, stb. készítenek belőle.
- A "monelfém" réz-nikkel
ötvözet tengervíz-álló.
- Az ólombronz csapágybélésként
használt rézötvözet (15-25-35% ólommal).
- A tombak (hamisarany) műtárgyak készítésére használt rézötvözet . Max.
9% cinket, ónt,
esetleg kevés ólmot tartalmaz.
- A konstantán elektromos
ellenállások, hőelemek alapanyaga. Nagyjából 60% réz és 40% nikkel
alkotja. Erre használják a manganint
is.
- A deltafém hajóalkatrészek készítésére alkalmas ötvözet.
Jól ellenáll a tengervíz korrodáló hatásának (57-58% réz, 40% cink,
0,2-2,0% vas, ólom,
nikkel, mangán
alkotja).
Réz vegyületeket
nagy mennyiségben használnak növényvédő
szerekként (gombaölő
szer), festékekhez,
stb. Az egyik "legősibb" növényvédőszer a "rézgálic"
(réz-szulfát CuSO4).
Biológia:
Alsóbbrendű növényekre, gombákra erősen mérgező.
Magasabb rendű élőlények viszont igényelnek bizonyos mennyiségű rezet,
emlősökre nem káros.
Az emberi szervezet számára kis mennyiségben nélkülözhetetlen elem. Egy felnőtt
ember szervezetében körülbelül 80 mg-ot találunk belőle, főleg az agyban, a
szemben, a májban, a szívben, a vesékben és az izmokban.
Sok enzim alkotórésze. A szervezetben 90%-a egy speciális
fehérjéhez, az úgynevezett cöruloplazminhoz kötődik.
Részt vesz az oxidációs-redukciós folyamatokban, a vérképzésben és a központi
idegrendszer működésében.
Legjobb forrásai a hüvelyesek, a gabonafélék és a máj.
Felhasznált irodalom
 Név: Cuprum - latin (Ciprus szigetének nevéből - már az ókorban fontos
rézlelőhely volt.)
Név: Cuprum - latin (Ciprus szigetének nevéből - már az ókorban fontos
rézlelőhely volt.) Oxidjából
Oxidjából  Ezt azonban
még tovább kell finomítani.
Ezt azonban
még tovább kell finomítani. 
 A
A