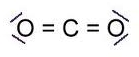 CO2 Színtelen, szagtalan, a levegőnél
nehezebb gáz.
CO2 Színtelen, szagtalan, a levegőnél
nehezebb gáz. Időnként emlegetik (helytelenül) szénsavként, illetve mustgázként is.
szén-dioxid
(mustgáz, E 290)
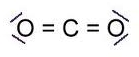 CO2 Színtelen, szagtalan, a levegőnél
nehezebb gáz.
CO2 Színtelen, szagtalan, a levegőnél
nehezebb gáz.
Időnként emlegetik (helytelenül) szénsavként,
illetve mustgázként is.
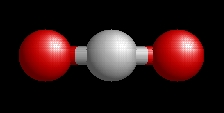
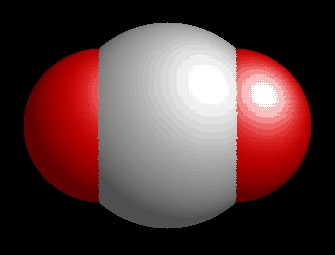
A szén-dioxid molekulaképe balra golyó és pálcika jobbra térkitöltéses megjelenítésben.
|
|
A CO2.pdb koordináta fájl térben megjeleníthető a https://sourceforge.net/projects/openrasmol/ címről letölthető molekulamegjelenítő programmal
Történet
Régóta ismert, tulajdonságait is leírták, de összetételét csak Lavoisier
állapította meg 1781-ben.
Előfordulás
Gyakori a természetben, a levegőnek
is állandó alkotórésze. (Az egyik leglényegesebb üvegházhatást
okozó összetevő.)
Alkoholos erjedésnél
is keletkezik, pl. amikor "forr" a must (mustgáz).
Egyes helyeken a talajból is előtör, pl. Répcelakon, ahol megtisztítva "szénsavpatronokba"
töltik és szódavíz (szénsav)
készítésére felhasználható.
A természetes vizek, főleg az ásványvizek oldott (szénsav)
formában tartalmaznak kisebb-nagyobb mennyiségben szén-dioxidot.
Széntartalmú vegyületek (elsősorban kőszén,
földgáz és kőolaj(származékok)
elégetésével évi 10
milliárd tonnás nagyságrendben kerül a légkörbe.
Előállítás
Szén (szén tartalmú vegyületek, pl. földgáz)
égésekor keletkezik:
C + O2 -> CO2
Szén-monoxid égésénél is szén-dioxid keletkezik:
2CO + O2 -> 2CO2
Keletkezik továbbá korhadásnál, alkoholos erjedésnél.
Iparilag füstgázokból lehet előállítani, ezek szén-dioxid tartalmát kálium-karbonáttal elnyeletik és a keletkező kálium-hidrogén-karbonát oldatból a szén-dioxidot kiforralják:
K2CO3 + CO2 + H2O <-> 2KHCO3
Laboratóriumban fehér márványdarabkákból fejlesztik sósavval, a keletkező gázt nátrium-hidrogén-karbonát oldaton vezetik át a magával ragadott sósav cseppecskék közömbösítésére:
CaCO3 + 2HCl = CO2 + CaCl2 + H2O
Karbonátok hő hatására történő szétesésekor is szén-dioxid keletkezik (mészégetés):
CaCO3 <-> CO2 + CaO
Fizikai tulajdonságok
Színtelen, szagtalan, nehéz gáz,
(egyik edényből a másikba átönthető!).
Már szobahőmérsékleten
is cseppfolyósítható megfelelő nyomáson.
Ha folyékony szén-dioxidot gyorsan elpárologtatnak, erősen lehül és
szénsavhóvá ("szárazjég")
fagy meg. Ennek szublimációs
pontja -78°C
A kristályos szén-dioxid szabályos rendszerű molekularács.
A molekula lineáris a rácsban és gázállapotban is (lásd a molekulaképen).
Az elektromos áramot
nem vezeti.
Kis dielektromos tényezőjű, rossz oldószer.
Kémiai tulajdonságok
Az erős C=O kötés miatt igen állandó, csak nagyon magas hőmérsékleten
disszociál kis mértékben
az alábbi egyenlet
szerint (1700°C-on mindössze 2%):
2CO2 <-> 2CO + O2
Hidrogénnel, megfelelő katalizátor, pl. finom eloszlású ruténium jelenlétében már 100-150°C-on metánná redukálható:
CO2 + 4H2 = CH4 + 2H2O
Alkálifémek és a magnézium szénné redukálják. Vas hasonló körülmények között szén-monoxiddá alakítja, miközben vas(II)-oxid keletkezik.
Fontos reakciója a szénsavképződés vízzel:
CO2 + H2O <-> H2CO3
a víz egyébként is jól oldja a szén-dioxidot,
a fenti reakció következtében kötött szénsav
is van a vízben. A szén-dioxid tehát
nem savanhidrid,
így fém-oxidokkal, -hidroxidokkal
és -peroxidokkal fém-karbonátokat
ad.
Fölöslegben lévő szén-dioxiddal hidrogén-karbonátok
is keletkezhetnek, pl.:
NaOH + CO2 =NaHCO3
2 NaOH + CO2 = Na2CO3
Felhasználás, termelés
 Sok szén-dioxidot
használnak üdítőitalok, ásványvízek szénsavval történő dúsítására, csapolt sörnél
hajtógáznak használják.
Sok szén-dioxidot
használnak üdítőitalok, ásványvízek szénsavval történő dúsítására, csapolt sörnél
hajtógáznak használják.
Tűzoltókészülékekben (a képen) töltésre, vagy porral oltó hajtógázaként
alkalmazzák.
Hegesztésnél védőgáznak
használják.
Laboratóriumban erős hűtésre használják a szilárd
szén-dioxidot, alkohollal,
acetonnal, vagy éterrel
keverve -80°C alatti hőmérséklet
érhető el.
Az iparban a Solvay-szódagyártásnál közbenső termék.
Nagy mennyiségben használják a cukoriparban
és a szerves-vegyiparban.
Élelmiszeripari célra nagyon tiszta kell legyen, mert a szénhidrogének,
vagy kénvegyületek már nyomokban is elrontanák
az élelmiszerek ízét.
Az élelmiszeriparban, mint hajtógázt
használják E 290 kóddal.
Kimutatás
Mészvízben [Ca(OH)2 oldata] vagy bárium-hidroxid oldatban zavarosodást,
vagy fehér csapadék kiválást okoz, amely feleslegben lévő szén-dioxiddal
ismét feloldódik.
Élettani hatás
Az állati szervezetek anyagcseréje állandóan termel szén-dioxidot ez
azonban mérgező volna, ha a szervezet nem távolítaná el.
A levegőben 10 % fölötti koncentrációban
már eszméletvesztést, halált okozhat. (A rendszeres figyelmeztetések ellenére
minden évben tucatszámra fordulnak elő halálesetek, amikor pincékben "forr
a must". A levegőnél
jóval nehezebb szén-dioxid /mustgáz/ "megül" a pincében és
könnyen kialakulhat a 10 % fölötti koncentráció.
Égő gyertyát kell
tartani minél lentebb, és ha elalszik nem szabad lemenni!)
A növények szén-dioxidot és vizet használnak a fotoszintézis
során. Üvegházakban a szén-dioxid koncentráció
növelésével (pl. szárazjéggel)
fokozható a fotoszintézis,
ezáltal a növények növekedése.