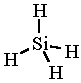 SiH4
SiH4
A metánhoz hasonló, de annál sokkal bomlékonyabb.
szilánok
(monoszilán, biszilán, triszilán, cikloszilánok)
A szilícium hidridjei.
Általános képletük SinH2n+2, a paraffin szénhidrogénekhez
hasonlóan.
monoszilán
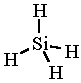 SiH4
SiH4
A metánhoz hasonló, de annál sokkal bomlékonyabb.
A monoszilán molekulaképe balra golyó és pálcika jobbra térkitöltéses megjelenítésben.
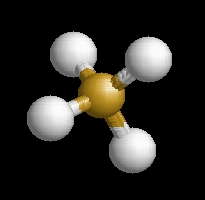
|

|
Az sih4.pdb koordináta fájl térben megjeleníthető a https://sourceforge.net/projects/openrasmol/ címről letölthető molekulamegjelenítő programmal
Előállítás
Magnézium-szilicidből híg sósavval
keletkezik, de egy része szét is esik, ezért fejlődő gáz
4-5 % monoszilán tartalmú hidrogén:
Mg2Si + 4 HCl = SiH4 + 2 MgCl2
A keletkező gázelegy más szilánokat is tartalmaz, amelyek szaggatott lepárlással különíthetők el.
Fizikai és kémiai tulajdonságok
Színtelen, enyhén dohos szagú, gáz.
Forráspont: -112,3°C-on
elbomlik
Olvadáspont: -184,7°C
Sűrűség: 0,7 g/ml,
folyadék fázisban.
Vízben nem oldódik.
Levegőn könnyen
oxidálódik, sőt
meg is gyullad (öngyulladó).
Magasabb hőmérsékleten elemeire esik szét.
Klórral robbanó elegyet képez.
Vízzel hidrolizál, lúgokkal még gyorsabban:
SiH4 + 2 OH- = SiO32- + 4 H2
A nagyobb molekulatömegű szilánok még bomlékonyabbak és levegőn
azonnal meggyulladnak.
(Az Si-Si kötés sokkal kevésbé stabil, mint a C-C kötés.)
A paraffin szénhidrogénekhez hasonlóan létezik biszilán (Si2H26),
triszilán (Si3H28), stb.
A cikloalkánokhoz hasonlóan léteznek cikloszilánok is.
Felhasználás
Számos ipari és gyógyászati alkalmazásuk létezik.
Használják pl. az üvegszálak műanyagba ágyazásának elősegítésére a kompozit anyagok gyártása során.
Alkalmazásukkal biológiailag semleges réteg alakítható ki a titán implantátumokon.
Redukálószerként is alkalmazzák a szilánokat a szerves és a szervetlen-vegyiparban egyaránt.
Biológia
A fentiekből nyilvánvaló, hogy a szilícium egyáltalán nem képes olyan sokféle,
stabil vegyület létrehozására, mint a szén, vagyis szilícium alapú élet nem
létezhet.
Ennek ellenére a sci-fi írók sokat fantáziáltak róla.