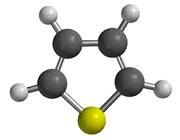
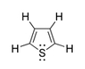
 C4H4S
C4H4S
tiofén
(tiofurán, tiociklopentadién, tienil gyűrű)

 C4H4S
C4H4S
Öttagú gyűrűből álló, kéntartalmú, heterociklusos vegyület.
A gyűrűrendszert tienil gyűrűnek is nevezik.
Előfordulás
A kőszénkátrányban megtalálható.
Történet
Viktor Meyer rájött, hogy az indofenon színreakciót nem a benzol, hanem szennyezése a tiofén adja. Elkülönítette a benzoltól és megállapította az összegképletét is.
Fizikai és kémai tulajdonságok
Színtelen, folyékony anyag.
Sűrűsége 1,051 g/cm3
Olvadáspontja -38°C
Forráspontja 84°C
Vízben nem oldódik. Apoláros oldószerekkel, például benzollal korlátlanul elegyedik.
Kémiai tulajdonságai hasonlítanak a benzoléra.
Könnyebben lép aromás elektrofil szubsztitúciós reakciókba, mint a benzol, gyűrűje viszont kevésbé stabil.
Lúgos közegben még oxidálószerek hatására sem változik.
Savakkal viszont bomlik.
Elektrofil szubsztitúciós reakciói könnyen végbemennek.
Könnyen nitrálható, szulfonálható, halogénezhető és Friedel-Crafts-reakcióban alkilezhető.
Tömény kénsavval szobahőmérsékleten szulfonálható.
Előállítás
Normál-butánból, 1-buténből, butadiénből, etilénből vagy acetilénből gőzfázisban kénnel hevítve 600 - 650°C-on. Pirit felületén 300-400°C-on is végbemegy a reakció.
Nátrium-szukcinátból foszfor-szulfidok keverékével tiofén képződik. Ezzel a módszerrel homológjai is előállíthatók.
2,3-dimetil-borostyánkősavból például 2,3-dimetiltiofén keletkezik.
Felhasználás
Mezőgazdasági vegyszerek és gyógyszerek fontos kiinduló anyaga.