 Név: ferrum - latin
Név: ferrum - latinvas / Fe
(ferrum, nagyolvasztó, vaskohászat, nyersvas, fehér nyersvas, szürke nyersvas, kovácsvas, torokgáz, vas(II)-vegyületek, ferro-vegyületek, vas(III)-vegyületek, ferri-vegyületek)
 Név: ferrum - latin
Név: ferrum - latin
Felfedezés:
Ősidók óta ismerik a természetes vasat, amely földi vagy meteoritos
eredetű.
A vaskohászatot valószínüleg a kisázsiai hettita nép találta fel.
Először faszenet és kézi fujtatókat alkalmaztak; később fejlődtek ki a nagyolvasztók
(lásd lentebb) és a kőszén
használata.
Rendszám: a
periódusos rendszer 26. eleme.
(Atomszerkezetileg a legstabilabb elem,
fúzióval vasig
épülhetnek fel elemek
energiabefektetés nélkül.)
Relatív atomtömeg: 55,87
Elektronkonfiguráció: [Ar](3d)6(4s)2
Izotópok:
A természetben négy izotóp
keverke.
Tíz további izotópja ismert.
Előfordulás:
A Föld magjának nagy
hányada vas.
A leggyakoribb nehézfém.
Elemi állapotban is előfordul.
Legnagyobb mennyiségben oxidos,
szulfidos és karbonátos
vasércek fordulnak elő. Fontos a hematit,
más néven vörös vasérc (Fe2O3), a magnetit
(Fe3O4), goethit (tűvasérc) (FeOOH) és ennek földes
változata a limonit.
A legfontosabb szulfid
a pirit (FeS2)
és a vele azonos összetételű markazit.
Karbonátos érc
a sziderit (FeCO3).
Igen elterjedt az olivin
[(Mg,Fe)2SiO4].
Rengeteg ásványa létezik.
Majdnem minden ásvány
tartalmaz valamennyi vasat.
A legalább 25% vastartalmú érceket
hasznosítják, de sokkal kedvezőbb a 40-65 % vastartalmú ércek
kohósítása.
Előállítás:
 Vegyületeiből
termikus bontással, elektrolízissel
vagy redukcióval
állítható elő.
Vegyületeiből
termikus bontással, elektrolízissel
vagy redukcióval
állítható elő.
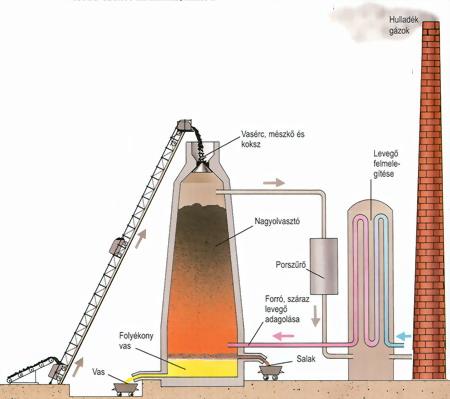
Nagyüzemileg hatalmas kohókban
(nagyolvasztó) (ábra), kokszosított
szénnel magas hőmérsékleten
oxidját fémmé
redukálják (vaskohászat).
Először nyersvas keletkezik, aminek magas széntartalmát
levegővel kiégetik.
Ekkor kovácsvas keletkezik; ezt szükség esetén ötvözik
a megfelelő anyagokkal.
Kétféle nyersvas létezik:
- a fehér nyersvas a szenet vegyület,
vaskarbid (cementit)
formájaban tartalmazza, ezér kemény, rideg
törete fehér, csak acéllá
finomítva használható
- a szürke nyersvas a nagyobb szilíciumtartalma
miatt a szenet lemezes grafit
zárványok formájában tartalmazza, ezert törete szürke, öntvények anyagaként
felhasználható
Legjelentősebb szennyezései a szén, kén,
szilicium, foszfor,
és a mangán, ami azonban a szénnel
együtt ötvöző anyagnak
tekinthető.
A kohóba mészkövet
is adagolnak salakképzőként.
Egy tonna nyersvas előállításához 800-1200 kg kokszot
használnak. Melléktermékként 550-660 kg salak
és 3700-4100 m3 torokgáz (főleg szén-monoxid
és nitrogén keveréke) keletkezik.
Fizikai tulajdonságok:
Szürkésfehér színű, elég lágy fém.
Szilárdsága szén és más szennyezések hatására
jelentősen nő.
Közönséges hőmérsékleten
rácsa tércentrált
köbös, magas hőmérsékleten
köbös legszorosabb illeszkedésű, még tovább hevítve újból köbös tércentrált
lesz.
Elektromos vezetőképessége
és méginkább mágneses viselkedése igen érzékeny a szennyezésekre.
Sűrűsége 7,87 g/cm3
Olvadáspontja 1536°C
Minden vasfém ferromágneses.
A nagyon tiszta vasnak sokkal jobbak a mágnesezési
tulajdonságai.
Generátorokhoz és
transzformátorokhoz
kis mágneses remanenciájú
vasat használnak, hogy kisebb legyen az átmágnesezési veszteség.
Kémiai tulajdonságok:
A vascsoport első eleme.
Közepesen aktív fém.
Hidrogént elnyel, de vegyületet
nem alkot vele.
Halogének - vízgőz
jelenlétében megtámadják, de a száraz klórt
lehet vas palackban tárolni.
Oxigén nedvesség távollétében csak felületén
oxidálja, a képződött
vékony oxidréteg megakadályozza
a további oxidációt.
Magasabb hőmérsékleten
az oxidáció gyorsul,
nagyon magas hőmérsékleten
oxigénben, sőt levegőn
is elég (csillagszóró, lángvágás);
nagyon finom eloszlásban levegőn
magától izzásba jön a gyors oxidáció
miatt (pirofóros).
Kénnel, szelénnel
és tellural is egyesül.
Nitrogénnel magas hőmérsékleten
sem reagál, de foszforral, arzénnel,
vagy antimonnal is hevítve vegyületet
alkot,
bizmuttal nem vegyül a szenet
az olvadt vas oldja és vegyületet
vagy ötvözetet alkot
vele, sziliciummal és a bórral
is.
Száraz sósav gáz csak
300°C-on kezd hatni rá. vizes sósav,
hidrogén-bromid és hidrogén-jodid
gyorsan oldja.
Híg kénsavban, valamint híg salétromsavban
oldódik; tömény salétromsav
passzívvá teszi.
A passzív vas
savakban általában nem
oldódik, csak a halogénhidridek támadják
meg.
Víz, oxigén
távollétében alig hat rá, oxigén jelenlétében
a korrózió sokkal
gyorsabb.
Kén-hidrogénnel vas(II)-szulfiddá
alakul.
Száraz ammónia 4-500°C-on
nitridet alkot vele.
Főleg ionvegyületeket
alkot, de vannak kovalens
kötésű atom-
és molekulavegyületei
is.
A vas(II)-ion
vegyületei halványzöld
színűek, könnyen oxidálódnak
vas(III)-vegyületekké.
Az utóbbiakban a vas kevésbé pozitív, könnyen hidrolizálódnak.
Két és három vegyértékű
ion egymás mellett is
előfordulhat, pl. a Fe3Br8-ban.
A vas(II)-vegyületek
(ferro-vegyületek) - amelyekben a vas +2 oxidációs állapotban van jelen,
és a vas(III)-vegyületek
(ferri-vegyületek) - melyekben a vas +3 oxidációs állapotban van jelen
könnyen átalakulhatnak egymássá oxidációval,
illetve redukcióval.
 Felhasználás:
Felhasználás:
A vas a legnagyobb tömegben és a legkülönfélébb célokra használt fém.
Legnagyobb mennyiségben építésre használják, betonacél,
váz szerkezetek, vasgerendák, vasúti sinek gyártására.
Rengeteget használnak csövek és huzalok, illetve lemezek gyártására.
Öntöttvasat
kevesebbet használnak (az összes termelés kb. 15%-a).
 Biológia:
Biológia:
Az élőlényekben nélkülözhetetlen elem,
a hemoglobin alkotórésze.
Életfontosságú, mivel biztosítja az oxigén
és szén-dioxid szállítását, az elektrontranszportokat,
a mioglobin szintézisét, részt vesz enzimek
működésében valamint a szállító- és raktárfehérjék
képződésében.
Az átlagos felnőtt szervezete 2,5-5 gramm vasat tartalmaz, legnagyobb részét a hemoglobinhoz kötve.
A vas legjobban állati eredetű élelmiszerekből szívódik fel, ez alapján
a legjobb vasforrások a húsok, a máj és az egyéb belsőségek.