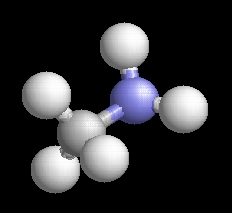
(A nyilakkal válthatja a molekulaképeket.)
aminok
(primer-, szekunder-, tercier aminok, aminocsoport, amincsoport, imino-csoport,
iminek,
többértékű aminok, etil-metil-amin, trimetil-amin, hexametilén-diamin,
1-amino-propán /n-propil-amin/, 2-amino-propán /izopropil-amin/)
Szerves ammóniaszármazékok, amelyekben egy vagy több hidrogénatomot alifás vagy ciklusos szénhidrogéncsoport helyettesít.
 |
Példák aminokra. (A nyilakkal válthatja a molekulaképeket.) |
Csoportosítás
Rendűség alapján
Az aminok esetében lényegében a "nitrogénatom
rendűségéről" van szó, vagyis arról hány hidrogénatomot
helyettesítünk szénhidrogéncsoporttal.
Így megkülönböztetünk
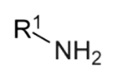
- primer aminokat (egy hidrogénatomot
helyettesítünk): RNH2 primer amin (-NH2 aminocsoport/amincsoport)
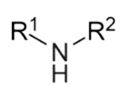
- szekunder aminokat (két hidrogénatomot
helyettesítünk): R2NH szekunder amin (-NH iminocsoport)
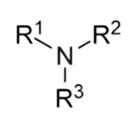
- tercier aminokat (három hidrogénatomot
helyettesítünk): R3N tercier amin
|
primer amin
|
szekunder amin
|
tercier amin
|
 |
 |
 |
A szekunder aminokat imineknek nevezik.
Ha egy ammóniumsó ammóniumionjában mind a négy hidrogénatomot helyettesítjük, akkor kvaterner ammóniumsóhoz jutunk:
[NH4]+X- -> ammóniumsó
[R4N]+X- -> kvaterner ammóniumsó
Értékűség alapján
Ha több aminocsoport van egy molekulában, akkor többértékű
aminokról beszélünk.
Elnevezés
Általában az éterekhez hasonló módszerrel történik (csoportfunkciós illetve
a szubsztitúciós nómenklatúra szabályai szerint), pl.
CH3-CH2-NH-CH3 etil-metil-amin
(molekulaképe fentebb látható)
CH3-NCH3-CH3 trimetil-amin (molekulaképe
fentebb látható)
Használatosak az úgynevezett triviális nevek is (általában aromás gyűrűt tartalmazó aminoknál), pl.
C6H5-NH2 anilin amino-benzol (fenil-amin) (molekulaképe fentebb látható)A primer aminok esetében az aminocsoport helyzetét is jelölni kell számmal, pl.
CH3-CH2-CH2-NH2 1-amino-propán
(n-propil-amin) (molekulaképe fentebb látható)
CH3-CHNH2-CH3 2-amino-propán
(izopropil-amin) (molekulaképe fentebb látható)
Fizikai és kémiai tulajdonságok
A primer és szekunder aminok hidrogénkötések
kialakítására képesek (donorok és akceptorok
egyaránt), ezért
olvadáspontjuk és forráspontjuk
viszonylag magas, de az azonos számú szénatomot
tartalmazó alkoholokénál
kisebb.
Az amincsoport elektrontaszító tulajdonságú.
A tercier aminok molekulái között nem jöhet létre hidrogénkötés,
ezért ezek az éterekhez hasonlóan alacsony
forráspontú vegyületek.
A kis molekulatömegűek az ammóniára
emlékeztető szagúak.
A nagyob molekulatömegűek undorító szagúak.
A kevéssé illékonyak pedig szagtalanok.
Vízben a kisebb méretű
aminok jól oldódnak (a vízmolekulákkal
még a tercier aminok nitrogénje
is hidrogénkötést tud létrehozni protonakceptorként),
de nem korlátlanul. Az anilin
igen gyengén oldódik vízben.
Egyes aminok optikai aktivitást
mutatnak, melyet a nitrogénatom
nemkötő elektronpárja miatt a funkcióscsoport
kiralitása okoz. A primer,
szekunder és tercier aminokban ugyanis a nitrogén
és a közvetlenül hozzá kapcsolódó három ligandum
ugyancsak piramisos elrendezésű (mint az ammónia
esetén). A piramisos szerkezetből adódóan a három különböző ligandumot
tartalmazó szekunder és tercier aminok királisak
(ide tartoznak a kvaterner ammóniumsók
is).
Gyenge bázisok, de a szerves
vegyületek között a legerősebbek:
R -NH2 + H2O <-> R -NH3+ + OH-
A báziserősséget a szénlánc hossza és rendűsége is befolyásolja. Mivel az alkilcsoport
elektronküldő csoport, ezért a primer amin erősebb bázis, mint az ammónia,
a szekunder amin még erősebb bázis. A tercier amin kevésbé erős
bázis, mivel növekszik a nitrogén körüli nagy térigényű csoportok száma és árnyékolják
a nitrogénatomot.
Az aril-aminok (pl. az anilin) jóval gyengébb bázisok, mivel az aminmolekula
nitrogénatomjának nemkötő elektronpárja, kölcsönhatásba lépve a delokalizált elektronrendszerrel stabilisabb elektronszerkezetet képvisel, mint a proton
megkötésekor képződő anilíniumion:
C6H5NH2 + H2O <-> C6H5NH3+ + OH-
(Ez összhangban van az alkoholok és fenolok sav-bázis tulajdonságaiban megmutatkozó különbségekkel.)
Erős savakkal alkotott sóik (aminsók) vizes oldatban savasan hidrolizálnak:
R -NH2 + HCl <-> R -NH3+ + Cl- (alkil-ammónium-klorid)
R -NH3+ + H2O <-> R -NH2 + H3O+ (savas hidrolízis)
Előállítás
Nitrovegyületek redukciójával, pl. az anilint nitro-benzolt
vasforgáccsal és sósavval
történő redukciójával:
C6H5NO2 + 2 Fe + 6 HCl -> C6H5NH2 + 2 FeCl3 + 2 H2O
RX + NH3 -> R -NH3+ X- (+ NH3) <-> R -NH2 + NH4X
A reakció során megjelennek többszörösen alkilezett származékok is.
Felhasználás
Műanyaggyártás, pl.
a NH2-(CH2)6-NH2 hexametilén-diamin
a nylongyártás egyik
alapanyaga.
Redoxiindikátorok (pl. difenil-amin)
Festékipar (pl. anilin).