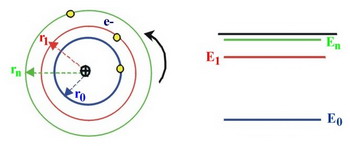
 Energiaszintek
a Bohr féle atommodell szerint.
Energiaszintek
a Bohr féle atommodell szerint.r0, r1, r2, ... rn az engedélyezett elektronpályák sugarai
E0, E1, E2, ... En az előbbi elektronpályákhoz tartozó energiaszintek.
energiaszint
(energianivó, term, multiplett, szingulett, dublett, triplett, kvartett)
A kvantumrendszerek meghatározott
energiaértékei.
Egy elektron energiaszintje egy atomban.
Az energiaszintet egy ’term szimbólum’ jellemzi, amelyet nagybetűvel jelölnek, jelezve, hogy ez az atom teljes pálya impulzusmomentuma,
L; a baloldali felülírás megadja 2S+1 értékét, ahol S az atom teljes spin impulzusmomentuma. Az egyetlen elektron impulzusmomentumára vonatkozó betűkkel analóg módon, az S, P, D, F megfelel L=0,1,2,3-nak.
Pl.: az L=1 és S=1 term jelölése: 3P.
Spin-pálya-csatolás hiányában a term degeneráltsága (2L+1)(2S+1).
A spin-pálya-csatolás jelenlétében a spin felhasad néhány közeli elektronzintre, ezen közeli elektronszintek csoportját multipletteknek nevezik. A multiplett multiplicitása (2S+1), minthogy az atomi energiaszintek száma, amelyekre az energiaszint felhasad a spin-pálya-csatolásnál (2S+1).
Ez azért alakul így, mert egy atom teljes elektronos impulzusmomentuma, J, (2S+1) lehetséges értéket vehet fel: L+S, L+S-1, stb.
Egy multiplett minden egyes szintjének van J értéke, a term jelölésénél jobboldalon alulírva.
Egy multiplettben a szint degenerációja: 2J+1.
A multiplettek elnevezései 2S+1=1,2,3,4 esetében szingulett, dublett, triplett, kvartett megfelel a multiplettben az atomszintek számának. Pl.: 3P1 a J=1 szint egy P triplettben.
A klasszikus mechanikai rendszerekben
az energiamennyiségek folyamatosan változhatnak.
Ezzel ellentétben a kvantumrendszerekben
az energiaszinteknek meghatározott, kitüntetett értékei vannak.
A kvantumrendszerek legkisebb energiájú
állapotát alapállapotnak nevezik.
 Energiaszintek
a Bohr féle atommodell szerint.
Energiaszintek
a Bohr féle atommodell szerint.
r0, r1, r2, ... rn az engedélyezett
elektronpályák sugarai
E0, E1, E2, ... En az előbbi elektronpályákhoz
tartozó energiaszintek.
Például az elektronok az atomokban
csak jól meghatározott energiaszinteket foglalhatnak el.
Egy alapállapotú atomban az elektronok
a legalacsonyabb energiaszinteken vannak.
Ha egy ilyen állapotú atom energiát
nyel el, egyik elektronja magasabb energiaszintre ugrik, és az atom
gerjesztett állapotba kerül. (Ez látható az alábbi animációban.)
|
A képre kattintva az atommag
körül keringő elektron egy nagyobb
energiájú pályára ugrik, majd
onnan visszazuhanva egy fotont bocsát
ki. Jellemző példa a fénycsövek felületén lévő bevonat atomjainak
viselkedése. |
A molekulák energiaszintjei Jablonski-diagrammal ábrázolhatók.