 Ionos
kötés
Ionos
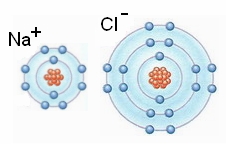
kötés mint pl. a konyhasóban (NaCl), amelyben a felépítő elemek elektronokat veszítenek és nyernek, a szerkezetet a Na+- és a Cl--ionok kölcsönös vonzása tartja össze, ionrácsot alkotva.
kémiai kötés
(ionos, fémes, egyszeres, kettős, hármas, telített vegyületek, telítetlen vegyületek,
kötéserősség)
Az atomokat molekulákban és nemmolekuláris szilárd állapotban összekötő elektromos erők.
Háromféle kötés létezik:
 Ionos
kötés
Ionos
kötés
mint pl. a konyhasóban (NaCl), amelyben
a felépítő elemek elektronokat
veszítenek és nyernek, a szerkezetet a Na+- és a Cl--ionok
kölcsönös vonzása tartja össze, ionrácsot
alkotva.
 Kovalens
kötés
Kovalens
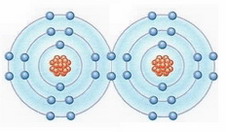
kötés
mint pl. a klórban (Cl2)
ahol egyes elektronok két atommaggal
állnak kapcsolatban.
 Fémes
kötés
Fémes
kötés
fémrácsot képező, mint a nátriumban
(Na), ahol a vegyértékelektronok a szilárdan
kötött fémionok között többé-kevésbé szabadon mozognak, miáltal elektromosan
vezetővé válnak.
Kovalens kötés, a kötést létesítő elektronpárok száma szerint többféle létezhet.
 egyszeres kötés
egyszeres kötés
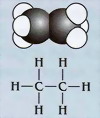
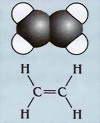
A jobboldali ábrán az etán
molekula és két szénatomja
közötti egyszeres kötésének jelölése látható.
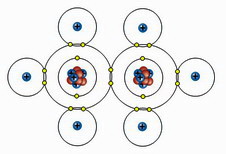
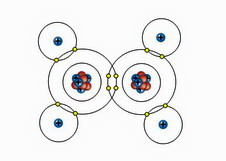
A baloldali ábrán a két szénatom
illetve a szénatomok és
a hidrogénatomok között
egyaránt 2 elektront magukba foglaló
kovalens kötések (szigma-kötés) láthatók.
 kettős
kötés
kettős
kötés
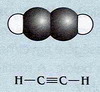
A jobboldali ábrán az etilén
molekula és két szénatomja
közötti kettős kötésének jelölése látható.
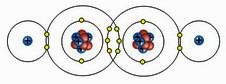
A baloldali ábrán a két szénatom
között 4 elektront, a szénatomok
és a hidrogénatomok
között 2 elektront magukba foglaló
kovalens kötések láthatók.
(A szénatomok között egy szigma-kötés és egy pi-kötés jön létre.)
 hármas
kötés
hármas
kötés
A jobboldali ábrán az acetilén
molekula és két szénatomja
közötti hármas kötésének jelölése látható.
A baloldali ábrán a két szénatom
között 6 elektront, a szénatomok
és a hidrogénatomok
között 2 elektront magukba foglaló
kovalens kötések láthatók.
(A szénatomok között egy szigma-kötés és két pi-kötés jön létre.)
A csak egyszeres kötéseket tartalmazó szerves
vegyületeket telített vegyületeknek nevezzük.
A kettős és/vagy hármas kötés(eke)t (is) tartalmazó szerves
vegyületeket telítetlen vegyületeknek nevezzük.
Azt az energiát, amelyik egy kémiai
kötés elszakításához (pl. egy klórmolekula
két klóratommá alakításához)
szükséges, kötési energiának,
vagy kötéserősségnek nevezik. A molekula
reakcióképességének fontos jellemzője.