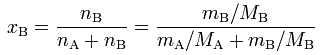koncentráció
(tömegszázalék, térfogatszázalék, vegyesszázalék, tömegkoncentráció, térfogati koncentráció, molaritás, molalilitás, mól/liter, móltört, mólszázalék, normál oldat, híg oldat, tömény oldat, koncentrált oldat)
A kémiában egy adott térfogatban
vagy tömegben található atomok,
molekulák vagy ionok
mennyisége.
Mérhetik mól-, térfogat-
vagy tömegegységekben.
A koncentrációkat lehetőleg az adott körülmények között célszerű módon
határozzák meg.
A tömegszázalék, %(m/m)
100 g oldatban lévő oldott
anyag grammokban kifejezett tömege:
%(m/m) = [mB / (mA + mB)] 100
ahol
mB az oldott anyag grammokban
kifejezett tömege
mA az oldószer grammokban kifejezett
tömege
 Egy ital
alkohol koncentrációját
általában térfogatszázalékban [%(V/V)] adják meg, vagyis mondjuk 1 liter
45%-os (45 V/V %) alkohol
oldat 4,5 deci tiszta alkoholt
tartalmaz. (A képen látható 0,2 literes pálinka nyilván ennek az ötödét,
vagyis 0,9 decit.)
Egy ital
alkohol koncentrációját
általában térfogatszázalékban [%(V/V)] adják meg, vagyis mondjuk 1 liter
45%-os (45 V/V %) alkohol
oldat 4,5 deci tiszta alkoholt
tartalmaz. (A képen látható 0,2 literes pálinka nyilván ennek az ötödét,
vagyis 0,9 decit.)
%(V/V) = [VB / V0] 100
ahol
VB az oldott anyag térfogata
V0 oldat 100 ml térfogata
A vegyesszázalék [%(m/V)] az oldat
100 cm3-ében oldott anyag grammban mért tömegét adja meg.
%(m/V) = [mB / V0] 100
ahol
mB az oldott anyag grammokban
kifejezett tömege
V0 oldat 100 ml térfogata
A tömegkoncentráció [rB] egy dm3
oldatban (V0) lévő oldott
anyag grammokban kifejezett tömege
(mB):
rB = mB / V0 [g/dm3]
ahol
mB az oldott anyag grammokban
kifejezett tömege
V0 oldat 1000 ml térfogata
Oldott szilárd anyag esetén praktikus
a térfogati koncentráció alkalmazása, ilyen lehet pl. vízben
oldott konyhasó koncentrációjának
megadása, ez az egy literben lévő konyhasó
gramjait jelenti (gramm/liter).
Különböző analitikai célokra használják
molaritást ami az oldott anyag
móljanak számát jelenti egy liter oldatban,
illetve a molalilitást, ami az 1 kg oldószerben
oldott anyagmennyiség
mólban kifejezve.
Szintén analitikai célra használatos
a mól/liter koncentráció, vagyis az, hogy az oldott
anyag hány molekulasúlynyi mennyisége
van egy liter oldószerben. (Pl. az egy
mól/liter töménységű konyhasóoldat 58,5
g NaCl-ot tartalmaz egy liter vízben.)
A móltört, xB (gázkeverékeknél yB) az oldott
anyag mólokban kifejezett kémiai anyagmennyiségének
(nB) és az oldatban lévő mólokban
kifejezett összes kémiai anyagmennyiség (nA + nB) aránya:
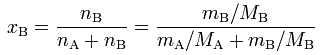
ahol
mB az oldott anyag grammokban
kifejezett tömege
MB az oldott anyag mólokban
kifejezett kémiai anyagmennyisége
mA az oldószer grammokban
kifejezett tömege
MA az oldószer mólokban
kifejezett kémiai anyagmennyisége
A mólszázalék, %(n/n), a móltört százszorosa:
%(n/n) = xB 100
Normál oldat esetén egy liter oldat
az adott anyag egyenértéksúlynyi mennyiségét
tartalmazza. (Pl. az egy normálos konyhasóoldat
58,5 g NaCl-ot tartalmaz, az egy normálos kénsavoldat 49 g kénsavat.)
Az olyan oldatot, amely viszonylag kis
koncentrációban tartalmaz oldott anyagot
híg oldatnak, amelyik nagy koncentrációban azt tömény (koncentrált)
oldatnak nevezik.
Felhasznált irodalom
 Egy ital
alkohol koncentrációját
általában térfogatszázalékban [%(V/V)] adják meg, vagyis mondjuk 1 liter
45%-os (45 V/V %) alkohol
oldat 4,5 deci tiszta alkoholt
tartalmaz. (A képen látható 0,2 literes pálinka nyilván ennek az ötödét,
vagyis 0,9 decit.)
Egy ital
alkohol koncentrációját
általában térfogatszázalékban [%(V/V)] adják meg, vagyis mondjuk 1 liter
45%-os (45 V/V %) alkohol
oldat 4,5 deci tiszta alkoholt
tartalmaz. (A képen látható 0,2 literes pálinka nyilván ennek az ötödét,
vagyis 0,9 decit.)