oxidáció-redukció
(redox, oxidációs szám, oxidációs állapot)
Eredetileg az oxidációt egyszerűen úgy tekintették, mint az oxigénnel történő
kémiai reakciót.
Az ellentett folyamatot - az oxigén elvesztését - redukciónak nevezték.
A hidrogénnel történő reakciót szintén redukciónak tekintették.
Később, egy általánosabb elvet dolgoztak ki az oxidációra-redukcióra,
amelyben az oxidáció elektronleadással,
a redukció elektronfelvétellel járó
reakció.
Ez a szélesebb definíció magába foglalta az eredetit. Pl. a következő reakcióban
4 Na (s) + O2 (g) -> 2 Na2O (s)
a nátriumatom elektront ad le és Na+ ionná válik, oxidálódik. Ezzel egyidejűleg az oxigénatomok elektront vesznek fel és redukálódnak.
Az oxidáció-redukció e definíciója olyan reakciókra is alkalmazható, ahol oxigén nem vesz részt a reakcióban, például:
2 Na (s) + Cl2 (g) -> 2 NaCl (s)
a nátrium oxidálódik és a klór redukálódik.
Oxidáció és redukció történik a galvánelemekben az elektródoknál is.
Az oxidációnak-redukciónak ez a definíciója csak olyan reakciókra érvényes,
amelyekben elektronátadás történik,
azaz ionos reakciókban. Kiterjeszthető azonban a kovalens vegyületek közötti
reakciókra is, az oxidációs szám (állapot) alkalmazásával. Ez
annak a kifejezésére szolgál, hogy milyen mértékben kontrollálja egy atom az
elektront/ elektronokat
a vegyületben, az elemi állapotához képest.
Az oxidációs szám két részből áll:
(1) előjelből, amely jelzi, hogy az elektron-kontroll nő (negatív) vagy csökken (pozitív);
(2) és az értékéből, amely számszerűen fejezi ki az elektronokat, amelyek fölötti rendelkezése megváltozott.
Az elektronok kontrollja lehet teljes (ionos vegyületeknél), vagy részleges elektronátadás (kovalens vegyületeknél). Pl.: SO2-ben a kén oxidációs száma +4, mivel a kén 4 plusz elektron felett rendelkezik az elemi kénhez képest. Az oxigén oxidációs száma -2, mivel minden oxigén részlegesen elveszítette a kontrollt két elektron fölött a gázhalmazállapotú oxigénben lévő oxigénatomokhoz képest. Az oxidáció az oxidációs szám növekedésével, a redukció a csökkenésével jár. Így
2 H2 + O2 -> 2 H2O
reakcióban a hidrogén (a vízben) +1 és az oxigén -2 oxidációs állapotú. A hidrogén oxidálódott, az oxigén redukálódott.
Az oxidációs számot használják a szervetlen
vegyületek elnevezésében is. A kén(VI)sav
(H2SO4), amelyben a kén
oxidációs száma +6.
Azok a vegyületek, amelyek könnyen
redukálhatók oxidálószerek,
azok amelyek könnyen oxidálódnak redukálószerek.
(Lásd még az oxidációs foknál.)

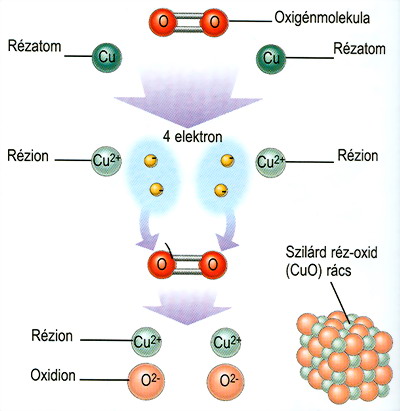
Az ábra a réz-oxid keletkezésekor mutatja be a redoxireakciók elvét.
A végbemenő reakcióban a réz
elektronokat ad le, vagyis oxidálódik.
Ugyanakkor az oxigén
elektronokat vesz fel, vagyis redukálódik.
Vagyis a redoxireakciók elektronátmenettel
járó folyamatok.