
sósav
(hidrogén-klorid, sósavgáz, acidum muriaticum, acidum hydrochloricum, királyvíz,
E 507)
HCl illetve vizes oldata.
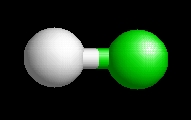
A sósav molekulaképe balra golyó és pálcika jobbra térkitöltéses megjelenítésben.

|

|
A Sosav.pdb koordináta fájl térben megjeleníthető a https://sourceforge.net/projects/openrasmol/ címről letölthető molekulamegjelenítő programmal
Történet
Már az alkimisták is ismerték. Először
"acidum muriaticum" latin néven említették.
Később, összetételére utalva az "acidum hydrochloricum" nevet
kapta.
Előfordulás
Vulkáni gőzökben néha nagy mennyiségben megtalálható és folyók vizébe is belekerül.
Az emlősök gyomornedve is híg sósavat tartalmaz.
Előállítás
Közvetlenül elemeiből (hidrogénből és klórból) előállítható a következő láncreakcióval
(kék fénnyel megvilágítva):
Cl2 + hn -> 2Cl
Cl + H2 -> HCl + H
H + Cl2 -> HCl + Cl
Nagyüzemi előállítása ezzel a módszerrel történik, aminek elvét az alábbi animáció mutatja be.
 |
A sósavgyártás "első lépése" fotokémiai reakció, melynek során a klór molekulái kék fény hatására atomokra hasadnak. (A keletkező klóratomok reakcióba lépnek hidrogénmolekulákkal sósavmolekulákat és hidrogénatomokat képezve. A hidrogénatomok klórmolekulákkal reagálnak sósavmolekulákat és klóratomokat képezve.) A képre kattintva indítható az animáció. |
Előállítható alkálikloridokból (pl. konyhasóból) kénsavval:
NaCl + H2SO4 = HCl + NaHSO4
NaCl + NaHSO4 = HCl + Na2SO4
Fizikai és kémiai tulajdonságok
Színtelen, szúrós szagú gáz.
Erősen lehűtve színtelen folyadékká, tovább hűtve színtelen kristályokká alakul.
A folyékony, vízmentes
sósav nem vezeti az áramot.
A sósavgáz erősen nedvszívó ezért levegőn füstöl.
A víz mohón elnyeli.
Melegítve mindaddig vízgőz távozik, amíg az elegy 20,2% töménységet el nem ér.
Ez az elegy azeotróp, forráspontja 111°C.
A vizes sósav oldat H+ és Cl- ionokra
disszociál ezért jól vezeti az áramot.
Kémiai viselkedése függ a halmazállapotától is.
A sósavgáz oxigénnel, magas hőmérsékleten és megfelelő katalizátorral
klórrá és vízgőzzé oxidálódik.
Ammóniagázzal szalmiák-füstöt ad:
HCl + NH3 <-> NH4Cl
Sósavgáz hatására fém-oxidok, fémek, bromidok, jodidok, karbonátok a
megfelelő kloridokká alakulnak.
Vizes oldata a legerősebb savak egyike,
teljesen disszociál H+ és Cl- ionokra.
Az egyetlen közönséges erős sav, amely nem
oxidálószer.
Az alkálifémeket tűzjelenség kíséretében, az alkáliföldfémeket is rendkívül
hevesen oldja.
Feloldja az alumíniumot, cinket, kadmiumot, titánt, ólmot, ónt, krómot, mangánt,
vasat, kobaltot és nikkelt is.
Réz és higany csak oxigén jelenlétében oldódik benne.
A nemesfémek (pl. arany, platina) és a tantál nem oldódnak benne.
Oxidokat, hidroxidokat, karbonátokat, szulfidokat, nitrátokat, stb. kloridokká
alakít.
Salétromsavval különböző reakciói vannak, miközben klór és nitrozil-klorid keletkezik:
HNO3 + 3 HCl = 2 Cl + NOCl + 2 H2O
Az úgynevezett királyvíz 3 rész tömény sósav és 1 rész tömény salétromsav elegye oldja az aranyat (alábbi egyenlet) és a platinát is.
Au + HNO3 + 4 HCl = H[AuCl4] + NO + 2 H2O
A nitrogén-monoxid a klóratommal nitrozil-kloriddá (NOCl) egyesül. Ez a köztes termék a királyvíz hatóanyaga.
(Az ezüstöt nem oldja, mert az oldhatatlan kloridot képez.)
 Felhasználás
Felhasználás
Széles körben használják általános savként.
A háztartási "vízkőoldószerek"
nagyrészt sósavat tartalmaznak.
Alkalmazzák fémek tisztítására, a textiliparban, a festékgyártásnál, illetve
laboratóriumi vegyszerként.
Az élelmiszeriparban sav-szabályzóként
használják.
Élelmiszeradalékként kódja E 507.
Gyomorsav hiánya esetén gyógyszerként is adják.
Biológia
Az emberi gyomorsav 2%-os sósav. Más emlősök gyomornedvében is megtalálható.
Ez biztosítja a megfelelő közeget a pepszin nevű fehérjebontó enzim működéséhez.
A sósavgáz erősen roncsoló hatású a tüdőszövetekre.