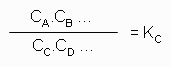
tömeghatás törvénye
(tömeghatás, aktív tömeg)
A kémiai reakciók egyensúlyára érvényes összefüggés, amely szerint homogén (egyfázisos) rendszerben, kémiai egyensúlyban a kiindulási anyagok koncentrációi szorzatának és a keletkező anyagok koncentrációi szorzatának hányadosa meghatározott hőmérsékleten állandó.
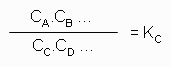
(Vagyis, ha az egyik anyag koncentrációját megnöveljük, olyan reakció fog lejátszódni, amely ennek az anyagnak a koncentrációját csökkenti.)
A tömeghatás törvénye kimondja, hogy a kémiai
reakció sebessége arányos a reagáló
anyagok aktív tömegeinek szorzatával.
A reagáló anyagok
aktív tömegét moláris koncentrációban
adják meg.
Például: xA+yB termékek reakciójára a sebességet a következő egyenlet adja:
R=k[A]x [B]y,
ahol k a sebességi konstans.
A törvényt C. M. Guldber és P. Waage fogalmazta meg, 1863-ban.
Szigorúan csak ideális gázokra érvényes.
Valódi gázok esetében
az aktivitás használható.