
2019 - A Periódusos Rendszer Nemzetközi Éve
Az ENSZ közgyűlése 2017. december 20-án, 74. plenáris ülésén a 2019-es évet
a Periódusos Rendszer Nemzetközi Évének nyilvánította.
Ennek célja, hogy felhívják a figyelmet a kémia
fontosságára a fenntartható fejlődés előmozdításában, valamint az energiaipar,
az oktatás, a mezőgazdaság és az egészségügy globális kihívásainak megoldásában.
A periódusos rendszert 1869-ben hozta nyilvánosságra Dimitrij Ivanovics Mengyelejev orosz kémikus és az idén ünnepli 150. születésnapját. Azóta is folyamatosan gyarapodott és tovább bővítette ismereteinket a kémiai elemekről.

"Ős periódusos rendszer" három évvel Mengyelejev publikációja után
Mivel a kémia az egyik fő témaköröm, az évek során - mint korábban a Föld éve vagy a kémia éve kapcsán is - "kötelességemnek" érzem, hogy én is készítsek egy összeállítást periódusos rendszerről. Kicsit szeretném körüljárni az előzményeket és a keletkezése óta eltel 150 évben végbement fejlődést. Mindenképpen meg kell emlékezni az alkotóról Mengyelejevről is. Az összeállítást egy kezdeti állapotában már feltettem és év közben még tovább bővítem majd.
Az összeállításban felhasználtam az Élet és Tudomány 2019/1 számában a témáról írtakat.
A periódusos rendszer az egyik legjelentősebb mérföldkő a tudományban, mivel egységet teremt a csillagászat, a kémia, a fizika, a biológia és más természettudományok között.

Ha valaki tanult valaha kémiát , biztosan maradt valami "emlékképe" a periódusos rendszerről, még akkor is, ha nem szerette a kémiát. A fentebb látható megjelenési forma időről-időre változott, változik, nehéz két egyforma változatot találni, de a mögötte rejlő törvényszerűségek változatlanok. Nem egy egyszerű táblázatról van szó, egy természeti törvényt, a periodicitás törvényét jeleníti meg, aminek az okát csak az elektronok sokoldalúságának megismerésével sikerült megfejteni.
A periódusos rendszer a csillagok magjában fúzióval és a szupernóva robbanásokban létrejött elemeket tartalmazza. Ekkor alakult ki a periodicitás, hiszen az atomtömeg monoton változik a rendszám függvényében.
Bizonyos periodicitást már Mengyelejev
előtt is észrevettek (Döbereiner
- triádok, Newlands-törvénye).
Mengyelejev jött rá arra, hogy az atomtömeg mellett a vegyülési arány, a vegyérték
is fontos, néha fontosabb. Például az ón és az ólom a szénhez hasonló oxidjaik
(vagyis a vegyértékeik) miatt kerültek ugyanabba az oszlopba.
Később jött rá Moseley, hogy a rendszerezés elvénél nem az atomtömeg, hanem
az "atomszám", vagyis az elektronok számát meghatározó protonok száma,
a rendszám fontos.
Mengyelejev rendszerezése tulajdonképpen a kor szintézise. Kifejezi, hogy a vegyülési törvények az összes elemre érvényesek. Ezt az űrkémia, a meteoritok, az üstökösök, a holdkőzetek összetételei, a különböző csillagászati eszközökkel végzett spektroszkópiai vizsgálatok igazolták.
A periódusos rendszer Mengyelejev nyomán táblázatból törvénnyé emelkedett. Ez a törvény határozta meg a legősibb vegyületek kialakulását, amikből az ásványok, kőzetek, égitestek kialakultak.
A periodicitás törvényének
az atommodellek fejlődésében
is lényeges szerepe volt. (Lásd lentebb az "Amit azóta megismertünk"
részben.
 Dimitrij Ivanovics Mengyelejev (1834 - 1907) orosz vegyész, természettudós
Dimitrij Ivanovics Mengyelejev (1834 - 1907) orosz vegyész, természettudós
Tobolszkban született, a helyi gimnázium igazgatójának tizenhetedik (és tizenharmadik
életben maradt) gyermekeként.
Anyja üveggyárában is dolgozott itt, s első kémialeckéit egy száműzött politikai
fogolytól kapta.
Gyáruk leégése után az elszegényedett család Moszkvába költözött.
Moszkvában nem sikerült egyetemre bejutnia, végül Pétervárott végezte el a tanárképző
főiskolát.
Diplomájának megszerzése után tüdőbajt fedeztek fel nála, ezért az orvosok tanácsára
a Krím-félszigeten helyezkedett el.
1856-ban gyógyultan tért vissza Moszkvába, ahol fizikai
kémiai értekezésével magiszteri címet szerzett, majd egy év múlva egyetemi
oktató lett.
1859-ben állami ösztöndíjjal két évre Heidelbergbe küldték, ahol Bunsennel
dolgozott, a molekulák kohézióját
és a spektroszkópot tanulmányozta.
Hazatérve 1864-ben a műegyetem kémia professzora
Szentpéterváron.
Később a Szentpétervári Egyetem általános kémiai
tanszékének vezetője lett, s az intézményt nemzetközileg is elismert tudományos
központtá alakította.
1868-70 között írta klasszikus művét, A kémia alapjait - ez a legjobb
és legszokatlanabb orosz nyelvű kémiakönyv.
Egy használható osztályozás kidolgozására törekedve kezdte vizsgálni a kémiai
elemek atomsúlyai közötti kapcsolatokat
és szabályszerűséget vett észre (A törvényszerűséget a német Lothar Meyer is
észrevette, de a felfedezést Mengyelejev publikálta előbb.)
1869-ben publikálta a nevét világhírűvé tevő periódusos
rendszert
Mengyelejev a rendszer logikája alapján meg merte változtatni az egyes
elemek sorrendjét, s az akkor ismert
63 elem mellett üres helyeket is hagyott.
Sőt, megjósolta az oda illő új elemek
létét és tulajdonságait is, amihez nem kevés tudományos bátorságra volt szükség.
A rendszer helyessége 1875-ben bizonyosodott be, amikor felfedezték a Mengyelejev
által ekaaluminiumnak nevezett anyagot, a galliumot,
amely fizikai tulajdonságaival pontosan
beleillett az üresen hagyott rubrikába, majd néhány év múlva a germániumot
és szkandiumot.
Mengyelejev hirtelen a világ legismertebb és legelismertebb vegyésze
lett, csak úgy záporoztak rá a tudományos elismerések.
1867-ben Párizsban szerzett ismereteket az orosz szódagyártás
fejlesztéséhez.
1876-ban az Egyesült Államokban a kőolaj-bányászatot
tanulmányozta a kaukázusi kőolaj-kitermelés
megszervezése érdekében.
Nagy szerepe volt a donyecki kőszénmezők
feltárásában és kiaknázásában is, s ő dolgozta ki az ásványi szenek fűtőértékét
meghatározó eljárást.
A fizikai kémia terén végzett vizsgálatai
közöl kiemelkedik a kritikus hőmérséklet
létezésének megállapítása1860-ban, amely felett a gázok
nem cseppfolyósíthatóak.
Felismerte az általános gáztörvényt:
a nyomás, hőmérséklet
és térfogat kapcsolatát.
Kutatta az oldatok kémiáját, s a vegyészet
mezőgazdasági hasznosítását.
Feltalált egy füst nélküli lőport.
Nagy érdemeket szerzett az állami mérésügy
vezetőjeként.
Foglalkozott a hőtani jelenségekkel, a különféle halmazállapotú
testek kiterjedésével, fizikai, kémiai átalakulásaival.
Léghajóval is kísérletezett, 1887-ben
teljesen egyedül emelkedett a magasba, hogy lefényképezzen
egy napfogyatkozást,
s bár a jármű kezeléséről semmit sem tudott, biztonságban ért földet.
Liberális nézetei, a diákság elnyomását bíráló nyilatkozatai miatt többször
került összeütközésbe a cári rendszerrel.
1880-ban nem választották meg az akadémia rendes tagjává.
1890-ben a diákság egy petíciójának támogatása miatt nyugdíjazták, s többé nem
kapott tudományos beosztást.
Mengyelejev az egyszerű emberekkel rokonszenvezett, még világhírű tudósként
is a vonat harmadik osztályán utazott, hogy társaságukban lehessen.
Lánglelkű hazafi is volt, így a rendszerrel szemben táplált fenntartásai ellenére
az orosz-japán háború 1904-es kitörése után támogatta a háborús erőfeszítéseket.
1906-ban, néhány hónappal halála előtt felmerült a neve a Nobel-díj kapcsán,
de a kitüntetést végül a francia Henri Moissan
kapta.
Szentpétervárott halt meg.
Nevét a periódusos rendszer
101-es rendszámú,1955-ben felfedezett,
eleme a mendelévium
(Md) őrzi.
Mi vezetett a periódusos rendszer felismeréséhez, kik járultak hozzá.
 Bár közvetlenül nincs köze a periódusos
rendszerhez, mindenképpen meg kell említeni Antoine
Laurent Lavoisier (1743-1794) francia kémikust, a modern kémia megteremtőjét.
Bár közvetlenül nincs köze a periódusos
rendszerhez, mindenképpen meg kell említeni Antoine
Laurent Lavoisier (1743-1794) francia kémikust, a modern kémia megteremtőjét.
A kémiában ő kezd el
először mérni, ő vezeti be a mérleget,
mint elengedhetetlen segédeszközt.
A levegő és a víz
összetett voltának a felfedezése, az oxigén,
a nitrogén és a hidrogén
megismerése kapcsán a mai felfogáshoz hasonlóan minősítette az egyes anyagokat
elemmé. Szerinte
az elemeket kémiai
módszerekkel nem lehet tovább bontani.
Mérés nélkül a vegyületekben
az elemek tömegarányainak megismerése nem lenne lehetséges és nehezen jutottunk
volna el a periodicitás
törvényéhez.
 Fontos lépés volt a periódusos
rendszerhez, Johann Wolfgang Döbereiner (1780 - 1849) német vegyész felismerése.
Fontos lépés volt a periódusos
rendszerhez, Johann Wolfgang Döbereiner (1780 - 1849) német vegyész felismerése.
1829-ben felhívta a figyelmet a triádokra (pl. klór,
bróm, jód).
Megállapította, hogy az elemeket atomtömegük
szerint sorrendbe állítva, bizonyos tulajdonságaikban ismétlődés (periodicitás)
fedezhető fel.
 John Alexander Reina
Newlands (1837 - 1898) angol vegyész állította össze a kémiai
elemek első periódusos
rendszerét az atomtömegeik
alapján sorba rendezve.
John Alexander Reina
Newlands (1837 - 1898) angol vegyész állította össze a kémiai
elemek első periódusos
rendszerét az atomtömegeik
alapján sorba rendezve.
1865-ben publikálta az oktáv
törvényt, ezzel ő is hozzájárult a periódusos
rendszer kialakításához
 Julius
Lothar Meyer (1830 - 1895) német vegyész 1864-ben megjelent A kémia
korszerű elmélete című művében közölt egy 28 elemből
álló táblázatot, a vegyértékeik alapján
csoportosítva.
Julius
Lothar Meyer (1830 - 1895) német vegyész 1864-ben megjelent A kémia
korszerű elmélete című művében közölt egy 28 elemből
álló táblázatot, a vegyértékeik alapján
csoportosítva.
1868-ban már egy 57 elemből álló rendszert
készített, de azt csak Mengyelejev
periódusos rendszerének
megjelenése után tette közzé.
Megállapította, hogy az atomsúllyal
szabályosan változik a kémiai elemek
atomtérfogata.
Milyen ismeretekkel gazdagodtunk azóta. Kik járultak hozzá a kémiai elemkel kapcsolatos ismereteink bővítéséhez. Mi kellett még a jobb megértéshez.
 Henry Gwyn-Jeffreys
Moseley (1887 - 1915) angol fizikus, kémikus az elemek
röntgenszínképét vizsgálta.
Henry Gwyn-Jeffreys
Moseley (1887 - 1915) angol fizikus, kémikus az elemek
röntgenszínképét vizsgálta.
1913-ban felfedezte a róla elnevezett törvényt, amelyben egyszerű összefüggést
mutatott ki a röntgenszínképvonalak
frekvenciája és a kibocsátó elem
rendszáma között.
Ezzel bebizonyosodott, hogy az elemek
periódusos rendszerben
elfoglalt helyét a rendszám (az atommagban
lévő töltések - a protonok
- száma) határozza meg.
Felfedezése hozzájárult az atomszerkezet felfedezéséhez.
 Friedrich Hund német fizikus.
Friedrich Hund német fizikus.
A róla elnevezett Hund-szabályok
az atomok spektrumát
értelmezik. Egy sok
elektronos atomban,
két azonos n és l kvantumszámú
elektron legalacsonyabb energiaszintű
konfigurációjának meghatározására használatos.
Az oktett viselkedés
megértéséhez szükség volt az elektronok
hullámtermészetének
és mágneses viselkedésének
megértésére. Ehhez járult hozzá ő is.
 Wolfgang
Pauli (1890-1958) osztrák-svájci Nobel-díjas (1945) elméleti fizikus.
Wolfgang
Pauli (1890-1958) osztrák-svájci Nobel-díjas (1945) elméleti fizikus.
1925-ben megfogalmazta az atomfizika
róla elnevezett kizárási
elvét (Pauli-elv).
Az oktett viselkedés
megértéséhez szükség volt az elektronok
hullámtermészetének
és mágneses viselkedésének
megértésére. Ehhez járult hozzá ő is.
 Frederick
Soddy (1877-1956) angol Nobel-díjas (1921) kémikus.
Frederick
Soddy (1877-1956) angol Nobel-díjas (1921) kémikus.
1902-ben a radioaktív anyagok vizsgálata
során Rutherforddal arra a következtetésre
jutnak, hogy a sugárzás atomátalakulással
jár. Bevezetik a felezési idő fogalmát.
1911-ben bevezeti az izotóp kifejezést
az azonos kémiai sajátosságot mutató, de különböző tömegszámú
elemekre. (iszosz, gör.= azonos; toposz,
gör.= hely) Soddy az izotópok
létezését a radioaktivitással kapcsolatban
vezette be. Nyitott maradt az a kérdés, hogy nem radioaktív
elemeknél is fordulnak - e elő ilyenek?
 Niels
(Henrik David) Bohr (1885-1962) Nobel-díjas dán fizikus.
Niels
(Henrik David) Bohr (1885-1962) Nobel-díjas dán fizikus.
Nagyban előmozdította az atomszerkezet-elmélet
fejlődését, amikor a hidrogén
színképét egy atommodell
és a kvantumtérelmélet
segítségével értelmezte (1913).
Sikerült megjelenítenie az atomi
építkezés logikáját, a szerkezet és a tulajdonság közötti ok-okozati összefüggést.
A tulajdonságok periodikus ismétlődése az elektronburok
héjszerkezetében
tükröződik. A legkülső vegyértékelektronok
azonos száma hasonló (atomi)
tulajdonságokat kölcsönöz. Egy-egy héjhoz
maximálisan annyi elektront
rendelt, ahány elem
alkotja az adott periódust.
Bohr atommodellje
volt az első, ami a kémikusok számára is alkalmazhatóvá vált, mert megmagyarázhatóvá
tette az ionos vegyületek
képződési arányát.
A kevés elektronnal és kis elektronvonzó képességgel rendelkező fémek elektronátadással,
míg a nagy magvonzású nemfémes elemek elektronátvétellel egészülnek ki a nemesgázokra
jellemző oktett szerkezetté. A cserélt elektronok szükségszerű egyenértékűségéről
Faraday második törvénye gondoskodik: Ugyanannyi töltés (vagyis elektron) áthaladása
során a reakciópartnerek egymással egyenértékűek, amely nem csak az elektrolízisre,
hanem a redoxireakciókra is érvényes. A redoxiegyenletek rendezése során alkalmazott
matematikai fogalom, a legkisebb közös többszörös a cserélt elektronok egyenértékűségén
keresztül a kémiai egyenértékűséget, a reakciópartnerek egyenértékűségét fejezi
ki.
A különböző oszlopokban lévő elemek különböző számú vegyértékelektronnal rendelkeznek,
ennek ellenére az egyenértékűség törvényének betartásával az elektronokkal "szabadon
kereskedhetnek".
A vegyjelek azonban nem fejezik ki, hogy a hidrogén, az oxigén, a nitrogén kétatomos
molekulákat alkot. Annak ellenére, hogy a molekulák (képletek) közvetlenül nem
jelennek meg a periódusos
rendszerben, a hidrogénmolekulának fontos szerepe volt az elemek sorbaállításában.
A molekula fogalma Avogadro nevéhez fűződik.
 Amedeo Avogadro
(1776-1856) olasz tudós.
Amedeo Avogadro
(1776-1856) olasz tudós.
1811-ben megalkotta a róla elnevezett Avogadro-tételt,
amely szerint egyező hőmérsékletű
és nyomású tökéletes
gázok egyenlő térfogatai
egyenlő számú molekulát
tartalmaznak.
Tekintélyes kortársai nem csak életében, hanem halála után még sokáig nem fogadták
el felfedezését, pedig az a vegyülő gázok térfogati törvényének értelmezéséből
szükségszerűen következett. A molekulák tagadásának az lett a következménye,
hogy a viszonyítási alapul, tömegegységnek választott hidrogént változatlanul
atomos állapotúnak kezelték és a tömegét 1-nek vették.
Az elemek sorbaállítása szempontjából viszont nélkülözhetetlen volt a relatív atomtömeg minél pontosabb értéke.
 Stanislao
Canizzaro (1826-1910) olasz kémikus.
Stanislao
Canizzaro (1826-1910) olasz kémikus.
1811-ben Avogadro
elméletét vizsgálva megállapította a különbséget az atomok
és a molekulák között.
Ennek alapján bevezette az atomtömeget
és molekulatömeget
a kémia számítások alapjaként.
Canizzaro Avogadro elmélete alapján belátta, hogy ha a hidrogént kétatomos molekulaként kezelik, vagyis a tömegét 2-nek veszik, akkor megszűnik a probléma. Az atomtömegek körüli zűrzavar tisztázása érdekében 1860-ban konferenciát hívtak össze Karlsruhéban. Canizzaro megpróbálta elfogadtatni Avogadro cikkét, de érdektelenség fogadta. A kevesek között az érdekelt, a periódusos rendszerén dolgozó Meyer döbbent rá az igazságra.
A Bohr-modell teljesítőképességét 1916-ban Lewis terjesztette ki a molekulákra.
 Gilbert Newton Lewis (1875-1946) Amerikai fizikai-kémikus.
Gilbert Newton Lewis (1875-1946) Amerikai fizikai-kémikus.
Legismertebb munkáját az I. világháború alatt adták ki. Ebben kidolgozta az
atomok közötti kötések
és a közös elektronok (kovalens
kötések) leírását, s ezzel alapvető hatást gyakorolt a kémia
fejlődésére.
1923-ban újradefiniálta a sav fogalmát,
bármely atomra, amely elektront
képes felvenni (Lewis-sav), hogy a nyolcas stabil héjat
kialakítsa.
Ennek nyilván ellenkezője a bázis, amely
elektron donor (Lewis-bázis).
Lewis már nem jutott Avogadro sorsára. A megoldásra annyira szükség volt, hogy senki sem gondolkodott el azon a zavarba ejtő kérdésen, hogy a (kötő és nem kötő) párokat alkotó elektronok miért nem taszítják egymást. A nemesgázszerkezetre történő törekvés egyszerűen vitathatatlan törvénnyé vált.
A háttérben lévő okok feltárásához azonban már kevés volt Bohr törvényszerű atommodellje. A megértés érdekében az elektron további tulajdonságait kellett megismerni.
Stern és Gerlach felfedezi, hogy az elektronok nemcsak elektromos töltéssel, hanem saját mágnességgel is rendelkeznek.
 Otto
Stern (1888 - 1969) német származású fizikus
Otto
Stern (1888 - 1969) német származású fizikus
1922-ben Walter Gerlachhal felfedezik
a róluk elnevezett Stern-Gerlach effektust, ami a mágneses
mező kvantáltságát igazolta.
 Walter
Gerlach (1889 - 1979) német fizikus
Walter
Gerlach (1889 - 1979) német fizikus
1922-ben Otto Sternnel felfedezik a róluk
elnevezett Stern-Gerlach effektust, ami a mágneses
mező kvantáltságát igazolta.
Az új tulajdonsághoz fűződő következmények vetekednek az elektron de Broglie által felfedezett hullám sajátságával (kémiai alkalmazásra lefordítva: az elektron delokalizációs hajlamával).
 Louis
Victor Prince de Broglie (1892-1981) francia Nobel-díjas (1929) fizikus.
Louis
Victor Prince de Broglie (1892-1981) francia Nobel-díjas (1929) fizikus.
Híres doktori értekezését 1924-ben nyújtotta be a hullám-részecske
dualitásról, amelyben az anyaghullám
modellt javasolta. Ebben a munkájában összeegyeztette a fény
hullám és korpuszkuláris
elvét, és fontos a kvantumelméletben.
Mert, amíg két elektron azonos mágneses beállítással kétszeresen is taszítja egymást, két ellentétes mágnesezettségű elektron párt alkothat.
Az oktett viselkedés megértéséhez szükség volt az elektronok hullámtermészetének és mágneses viselkedésének megértésére is. A Hund-szabályok és a Pauli-elv határozza meg a héjak és alhéjak kialakulását. Az oktett tulajdonképpen négy elektronpárból álló, négy állóhullám állapot, egy gömbszimmetrikus (2s) és három, egymástól független irányba álló, egy csomósíkkal rendelkező állapot (2px, 2py, 2pz).
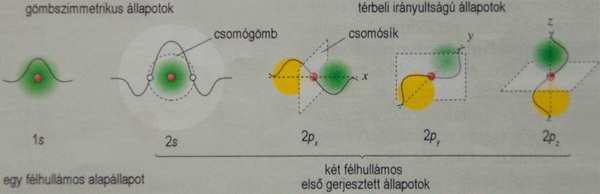
Az elektron sokoldalúságát
figyelembe vevő kvantummechanikai
atommodell egyszerre magyarázza meg, hogy miért nyolc elemből
áll a második periódus,
és mit jelent oktett
elméletet ihlető, reakcióképtelen
nemesgáz szerkezet.
(A párosítatlan elektronok a gyökökben
társat keresnek - reakcióképesek,
az atomon belül párt
alkotó elektronok
már nem keresnek társat más részecskében.)
Az oktett elmélet
lényege valójában nem is a nyolc, hanem a négyszer kettő, vagyis négy elektronpár.
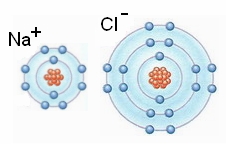 A szélsőséges tulajdonságokkal rendelkező nátrium- és klóratomok egy-egy párosítatlan
elektronnal rendelkeznek, ezért rendkívül reakcióképesek. A nátriumatom egy
vegyértékelektronjának átadásával elveszíti párosítatlan elektronját, míg a
klóratom párosítatlan elektronja "párra talál". A kialakuló négyszer
kettes nemesgáz-elektronszerkezet egyúttal nemesgáz tulajdonságot kölcsönöz.
Hiszen ezek az ionok szervezetünk élettani folyamataiban (például ingerületvezetés)
megnyugtató megmaradással hordozzák egységnyi elektromos töltésüket, és nem
lépnek reakcióba még a közeget képező vízmolekulákkal sem.
A szélsőséges tulajdonságokkal rendelkező nátrium- és klóratomok egy-egy párosítatlan
elektronnal rendelkeznek, ezért rendkívül reakcióképesek. A nátriumatom egy
vegyértékelektronjának átadásával elveszíti párosítatlan elektronját, míg a
klóratom párosítatlan elektronja "párra talál". A kialakuló négyszer
kettes nemesgáz-elektronszerkezet egyúttal nemesgáz tulajdonságot kölcsönöz.
Hiszen ezek az ionok szervezetünk élettani folyamataiban (például ingerületvezetés)
megnyugtató megmaradással hordozzák egységnyi elektromos töltésüket, és nem
lépnek reakcióba még a közeget képező vízmolekulákkal sem.
A Newlands által
megsejtett oktáv törvényt
150 éve tökéletesítette Mengyelejev
a periódusos rendszer
mégis örökifjú, mert állandóan megújul. Részben az "átszabások", részben
az újabb elemek felfedezése miatt.
Rutherford Nobel-díjjal jutalmazott elemátalakítása a vörös óriásokban lejátszódó fúzió egyik lehetséges lépését idézi fel:
14N + 4He = 17O + 1H
 Ernest
Rutherford (1871-1937) újzélandi születésű angol Nobel-díjas (1908)
fizikus.
Ernest
Rutherford (1871-1937) újzélandi születésű angol Nobel-díjas (1908)
fizikus.
A Manchesteri Egyetemen 1911 végzett híres szóráskísérlete
előtt úgy képzelték, hogy az atomok puha
pozitív töltésű pacnik, amelyek magukba
foglalják az elektronokat. De amikor
Rutherford vékony aranyfóliát
bombázott pozitív töltésű alfa-részecskékkel,
azt tapasztalta, hogy a részecskék
elég nagy hányada visszapattan.
A berillium alfa-részecskékkel történő besugárzása a neutron felfedezéséhez vezetett.
 James
Chadwick (1891-1947) angol Nobel-díjas (1935) fizikus.
James
Chadwick (1891-1947) angol Nobel-díjas (1935) fizikus.
1932-ben Chadwick alapvető felfedezést tett nukleáris tudomány területén,
igazolta a neutronok
létezését. Ezzel egy új hatékony, töltés nélküli részecske
állt rendelkezésre a nehéz atommagok
hasítására. Ezzel előkészítette az utat az urán
235 hasítása és az atombomba
létrehozása felé.
A neutronbesugárzást követő neutronbefogás újabb lehetőséget jelentett az atommagok mesterséges átalakítására. Az első hidrogénbomba felrobbantása után a neutronsugárzás következtében két új elemet fedeztek fel, az einstenium (99ES) és a fermiumot (100Fm).
 Az egyre nagyobb energiájú részecskegyorsítókban (a képen az LHC részlete),
atommagütköztetőkben rövid időre megjelennek olyan atommagok (elemek) is, amelyeket
rövid élettartamuk miatt a földkéreg már nem tartalmaz.
Az egyre nagyobb energiájú részecskegyorsítókban (a képen az LHC részlete),
atommagütköztetőkben rövid időre megjelennek olyan atommagok (elemek) is, amelyeket
rövid élettartamuk miatt a földkéreg már nem tartalmaz.
A 118-as rendszámú elem felfedezésével a periódusos
rendszer lezártnak tűnik. A nagyenergiájú kísérletekben azonban további
atommagok keletkezése is várható még.
A periódusos rendszer
a törvények rejtőzködő szintézise. Az atomok
alkotórészeinek megfelelően, a héj
a kémia, az atommag az elemek
sokféleségének határával vagy határtalanságával a nagyenergiájú fizika törvényeit
hordozza. A szerveződési szinteken egyre lejjebb haladva, a halmaz szintű törvények
okainak megismerése újabb törvények felfedezéséhez vezettek, melyek oka egyelőre
éppúgy ismeretlen, mint a korábbiaké volt.