cink-levegő elem
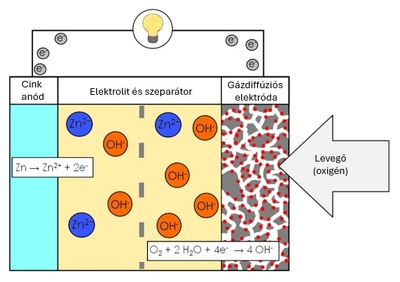 Egy a cink oxidációjával működő fém-levegő elektrokémiai cella. Kisüléskor cinkszemcsékből álló tömeg elektrolittal átitatott porózus anódot képez.
Egy a cink oxidációjával működő fém-levegő elektrokémiai cella. Kisüléskor cinkszemcsékből álló tömeg elektrolittal átitatott porózus anódot képez.
A levegő oxigénje a katódnál reakcióba lép hidroxid-ionokat képezve, amelyek a cinkpasztába vándorolnak és cinkátot (Zn(OH)42- képeznek, a katód felé vándorló elektronokat létrehozva.
Zn + 4OH- -> (Zn(OH)42- + 2 e- (E0 = - 1,25 V)
A cinkát cink-oxidra és vízre bomlik az elektrolitba (lúgos oldat) visszatérve.
(Zn(OH)42- -> ZnO + H2O + 2 OH-
A víz és a hidroxid az anódról újrahasznosul a katódnál, így a víz nem fogy el.
1/1 O2 + H2O + 2 e- -> 2 OH- (E0 = - 0,34 V pH = 11)
A teljes reakció a következő:
2 Zn + O2 -> 2 ZnO (E0 = - 1,59 V)
A reakciók elméleti feszültsége 1,65 V, de az a rendelkezésre álló cellákban 1,35 - 1,4 V-ra csökken.
 Alkalmazás
Alkalmazás
Elsősorban hallókészülékek
áramforrásaként.
Az elektromos áramot
termelő elektrokémiai
folyamatokat bemutató animációk találhatók a Kémia rész galvánelem
címszavánál.
Öveges tanár úr szemléletesen
foglakozik a szén-cink szárazelemekkel a Fizika blokk Hogyan működik a galvánelem? című részében.
Felhasznált irodalom
 Egy a cink oxidációjával működő fém-levegő elektrokémiai cella. Kisüléskor cinkszemcsékből álló tömeg elektrolittal átitatott porózus anódot képez.
Egy a cink oxidációjával működő fém-levegő elektrokémiai cella. Kisüléskor cinkszemcsékből álló tömeg elektrolittal átitatott porózus anódot képez.  Alkalmazás
Alkalmazás