 NH3
NH3 A nitrogén hidridje.
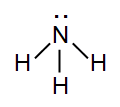
Magányos elektronpárt tartalmazó molekulája piramis alakú.
ammónia
(ammónium-hidroxid, szalmiákszesz)
 NH3
NH3
A nitrogén hidridje.
Magányos elektronpárt tartalmazó molekulája piramis alakú.
Az ammónia molekulaképe balra golyó és pálcika jobbra térkitöltéses megjelenítésben.

|

|
Az AMMONIA.PDB koordináta fájl térben megjeleníthető a https://sourceforge.net/projects/openrasmol/ címről letölthető molekulamegjelenítő programmal
Történet
Tevetrágya elégetésekor ammónium-klorid (NH4Cl) rakódik le a füstből.
Valamikor az egyiptomi Ammon isten temploma mellett találták meg lerakódott
sóit, innen a "sal ammoniacum" vagy szalmiáksó név.
Magát az ammóniát Priestley állította elő.
Elemeiből Haber és Le Rossignol szintetizálta 1923-ban.
Előállítás
Elemeiből keletkezik, de csak megfelelő katalizátorokkal (vas) érhető el kellő
sebesség:
3 H2 + N2 = NH3
A folyamat ipari alkalmazása a Haber-Bosch-eljárás. Legnagyobb mennyiségben ezzel állítják elő.
Ammóniumsók szétesésénél is keletkezik:
(NH4)2CO3 = NH3 + CO2 + H2O
Ha ammóniumsó vizes oldatát alkáli-hidroxiddal kezelik, akkor is ammónia szabadul fel, mivel a keletkező ammónium-hidroxid vízre és ammóniára bomlik:
NH4Cl + KOH = KCl + NH3 + H2O
Keletkezik amidokból, imidekből és nitridekből is hidrolízissel:
Mg3N2 + 6 H2O = 2 NH3 + 3 Mg(OH)2
Fizikai és kémiai tulajdonságok
Színtelen, szúrós, fojtó szagú gáz.
A levegőnél jóval könnyebb.
Olvadáspontja - 78°C.
Forráspontja - 33°C.
Relatív sűrűsége 0,59 (a levegőre vonatkoztatva)
Nagyon könnyen cseppfolyósítható,
nyomáson már szobahőmérsékleten.
Megfagyva molekularácsot alkot.
Trigonális, piramis alakú molekulaszerkezete van, kb. 107°-os kötési
szögekkel. (Lásd fentebb a molekulaképen.)
Molekulái asszociálnak, ezért forráspontja
és fagyáspontja magasabb a várhatónál,
dielektromos tényezője is elég nagy.
Sokféle anyagot old, ionrácsokat és
molakularácsokat egyaránt.
 Vízben rendkívül nagy
mennyiségű ammónia oldódik,
0°C-on 1200 térfogat, 20°C-on 700 térfogat 1 térfogat vízben.
Vízben rendkívül nagy
mennyiségű ammónia oldódik,
0°C-on 1200 térfogat, 20°C-on 700 térfogat 1 térfogat vízben.
Vízzel megfordíthatóan
ammónium-hidroxidot (NH4OH
- szalmiákszesz) képez:
H2O + NH3 <-> NH4OH <-> NH4+ + OH-
Az ammónium-hidroxid koncentrációja
csak néhány százalék, és az is csak kevéssé disszociál
ionjaira, mégis gyenge bázisként
viselkedik, mert ha hidroxilt vonunk
el belőle az egyensúly
igen hamar helyre áll.
Oldata lúgos, szolvatált ammónium molekulákat és kis mennyiségben NH4+ és OH- ionokat tartalmaz.
Savakkal ammónium ionok képződése közben reagál, sókat képez, pl. salétromsavval ammónium-nitrátot:
NH3 + HNO3 = NH4NO3 + H2O
Erős savakkal alkotott sói vizes oldatban savasan hidrolizálnak.
Az oxigénnel kevert ammóniagáz sárga lánggal ég el, miközben nitrogén
szabadul fel és vízgőz keletkezik.
A levegő - ammónia elegy 16
- 25% ammóniatartalom között robban.
Platina katalizátor felületén levegővel elegyítve salétromsavvá oxidálódik 500°C-on:
NH3 + 2 O2 = HNO3 + H2O
Alkálifémek és alkáliföldfémek ammóniában hevítve amidokká alakulnak.
A folyékony ammónia bizonyos mértékű hasonlóságot mutat a vízhez. Hidrogénkötések találhatók benne, közepes dielektromos állandója lehetővé teszi, hogy ionizáló oldószerként viselkedjen. Gyenge önionizációra képes, amely ammónium (NH4+) és amid (NHH2-) ionokat eredményez.
Az elektropozitív fémeket is oldja, ilyenkor kék oldatok keletkeznek, amelyekről úgy gondolják, hogy szolvatált elektronokat tartalmaznak.
 Felhasználás
Felhasználás
Évente millió tonnás mennyiségben állítják elő.
Nagy párolgáshője miatt hűtőgépekben alkalmazzák.
Fontos ipari vegyszer.
Legnagyobb mennyiségben salétromsav és nitrogén-műtrágyák
(pl. "pétisó" - NH4NO3) előállítására használják.
Készítenek belőle karbamidot is, amit
szintén alkalmaznak műtrágyaként és
műanyagok alapanyagul.
Vizes oldatát a szalmiákszeszt (a képen) folttisztításra, laboratóriumi
vegyszerként és egyéb célokra használják.
Biológia
Szembe vagy bőrre kerülve vörösséget, fájdalmat égést okoz.
Belélegezve égő érzés, köhögés, nehéz légzés jelentkezik.