 Olyan vegyület, amelyben a fématomokhoz "szabad elektronpár" átadásával
kapcsolódnak más atomok, molekulák vagy ionok, más néven komplexképzők.
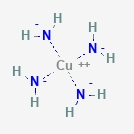
Olyan vegyület, amelyben a fématomokhoz "szabad elektronpár" átadásával
kapcsolódnak más atomok, molekulák vagy ionok, más néven komplexképzők. Leggyakrabban az átmeneti fémeknél figyelhető meg, de más esetekben is előfordul, a legegyszerűbb ionoktól, pl. a réz(II)tetraammónium - [Cu(NH3)4]2+ - iontól (ez látható a baloldali ábrán), az enzimekig, beleértve a hemoglobint (vaskomplex) és a klorofillt (magnéziumkomplex).
A központi atom a koordinációs vegyületeknek az a „kitüntetett” alkotórésze, amely több más atomok, vagy atomcsoportot köt magához, és ez által központi helyzetet foglal el a molekulán belül.
A hagyományos felfogás szerint a koordinációs vegyületben minden donoratom, vagy atomcsoport egy-egy elektronpár révén σ-kötéssel kapcsolódik a központi atomhoz, betöltve annak valamely megfelelő irányítottságú üres atompályáját. Ezért a központi atom környezetében megtalálható elektronok megszámlálása során - gondolatban - minden koordinált atomcsoporthoz egy-egy elektronpárt rendelhető.
A komplexek másik alkotórészei a ligandumok. Ezek a központi atomhoz koordinálódó atomok, ionok vagy atomcsoportok, amely részecskéknek a központi atommal kötést létesítő atomját donoratomnak nevezzük.
A tipikus komplexeknél a koordinációs szám tehát a ligandumok és a ligandumok közötti σ-kötések számával azonos.
A központi atomhoz kapcsolódó ligandumok koordinációs poliédert alkotnak, mely csúcsainak száma azonos a koordinációs számmal.
